DNA损伤——LncZFHX2很重要
合作单位:Zhejiang University
参考文献:Ni W, Zhang H, Mei Z, et al. An inducible long noncoding RNA, LncZFHX2, facilitates DNA repair to mediate osteoarthritis pathology. Redox Biology, 2023, 66: 102858. DOI: 10.1016/j.redox.2023.102858 (IF=10.7)
背景:
关节炎最普遍的形式是骨关节炎(OA),这是一种主要由关节软骨变性、滑膜炎症、软骨下骨硬化和骨赘形成引起的无菌性炎症。虽然OA是一种全关节疾病,但其发展的一个标志是由于软骨稳态失衡而导致的进行性软骨和细胞外基质(ECM)损失。软骨细胞的细胞内信号传导触发控制软骨稳态的合成代谢和分解代谢活动之间的相互作用。2型胶原蛋白(COL2A1)和聚集蛋白聚糖(ACAN)的表达促进ECM积累。COL2A1和ACAN的表达受SRY-Box转录因子9(SOX9)的调控。相比之下,基质金属蛋白酶(MMP)(如MMP13)和具有血小板反应蛋白基序的解整合素和金属蛋白酶(ADAMTS)蛋白(如ADAMTS5)的表达会增强ECM的降解。此外,细胞衰老也被认为与骨关节炎有关。在健康成人的关节软骨中,常驻软骨细胞是静止的,表现出低代谢活性,基质成分的周转很少。由于软骨是无血管的,软骨细胞存在于相对缺氧的环境中,并且修复或再生能力有限。越来越多的证据表明,精确氧分压(pO2,范围从6%O2从表面上看<深部区域为1%)对软骨稳态至关重要,影响广泛的过程,如软骨细胞代谢、蛋白质/蛋白多糖合成和细胞衰老。软骨细胞具有丰富的线粒体,尽管在缺氧环境中也能产生足够的ATP以维持合适的表型和代谢。然而,pO2低于某个阈值有助于促进ECM合成和抑制分解代谢。鉴于这些条件,软骨细胞对pO2的变化极为敏感。
软骨细胞对低pO2的反应机制是通过缺氧诱导因子(HIF)。HIF蛋白复合物由三个α亚基(HIF-1α、HIF-2α和HIF-3α)和一个组成型表达的HIF-1β亚基组成;后者存在于各种组织中,并受pO2的严格调节变体。缺氧反应期间的主要亚型是HIF-1α,它通常用作缺氧指示剂。在低pO2(2-3%),HIF-1α在软骨细胞中上调,而较高的pO2减少ATP生成。HIF-1α是早期骨骼发生过程中软骨形成的关键组成部分,可调节缺氧软骨形成细胞中SOX9的表达。通过维持ECM完整性和抑制细胞凋亡,HIF-1α是软骨稳态的生存因子,主要通过HIF-1α和HIF-2α的相对表达变化进行调节。HIF-1α刺激可提高软骨细胞存活率,而该蛋白的条件性缺失会导致软骨细胞死亡。
氧化应激是由活性氧(ROS)压倒细胞抗氧化能力引起的。由于软骨细胞对pO2的变化极为敏感,持续的常氧严重损害软骨细胞中的DNA,如H2A组蛋白家族成员X(H2AX)的磷酸化和各种衰老表型所示。考虑到OA的衰老和缺氧在衰老中的重要性,可以通过更好地了解各种氧水平下的软骨细胞稳态来改进治疗。一个有前途的研究目标是非编码RNA(ncRNA),它对软骨细胞过程的调节很重要。目前,关于ncRNA在生理缺氧下如何影响软骨细胞稳态的研究很少。
大约60%的DNA转录本是ncRNA,根据长度、生物合成和作用机制分类。转录后,ncRNA可能高度保守(例如microRNA、miRNA;环状RNA、circRNA)或相对不保守(例如长ncRNA、lncRNA)。无论如何,它们独特的二级和三级结构使ncRNA能够参与关键的生物学功能。特别是,lncRNAs影响其他RNA的翻译,从而在基因调控网络中发挥作用。lncRNA与其RNA靶标的结合要么产生蛋白质功能的底物,要么消除对miRNA和抑制性蛋白质效应子的访问。在这项研究中,鉴定了一种保守的lncRNA(LncZFHX2),它在正常软骨中被HIF-1α上调。LncZFHX2通过激活复制时序调节因子1(RIF1)驱动软骨细胞中的DNA修复。值得注意的是,LncZFHX2条件性敲除小鼠在手术破坏内侧半月板不稳定后表现出严重的OA。数据表明存在一种对维持软骨稳态至关重要的新型lncRNA依赖性机制。
主要结果:
mLncZFHX2在体内和体外调控OA进展
为了研究mLncZFHX2与OA的关系,利用RNA FISH法检测了多种OA模型中mLncZFHX2的表达。在自然年龄小鼠(12个月和24个月)中,mLncZFHX2以年龄依赖的方式从对照组(6个月小鼠)水平下降。Safranin O/Fast Green染色和OARSI评分证实实验小鼠发生OA。此外,关节免疫组化显示P21随着年龄的增长而增加。作为进一步的证据,与CBA/ CaCrl对照相比,自发性OA STR/Ort小鼠的mLncZFHX2水平显著降低(图1E)。这些数据均提示mLncZFHX2在OA中起重要作用。
Western blotting显示,mLncZFHX2敲低可上调MCs中的MMP13、ADAMTS5、P16INK4a和P21,但下调SOX9、COL2A1和ACAN(图1F和G)。为了进一步验证mLncZFHX2的缺失是否会加速ECM的丢失,使用CRISPR/Cas9技术完全消除了ATDC5细胞中的mLncZFHX2。用PCR验证了基因编辑的成功,并选择了供体7作为mLncZFHX2敲除(KO)细胞系。然后确认供体7的KO状态。接下来,在KO ATDC5细胞中过表达mLncZFHX2,并用RT-qPCR验证了其效率。合成代谢因子SOX9、COL2A1和ACAN在KO ATDC5细胞中的表达明显低于野生型细胞。过表达mLncZFHX2挽救了ECM的损失,这表明mLncZFHX2在软骨细胞稳态中发挥了有价值的功能。此外,流式细胞术显示,随着mLncZFHX2基因敲低,MC细胞凋亡增加(图1)。在体内实验中,雄性C57BL/6小鼠关节注射ASO mLncZFHX2或ASO对照组,持续12周。mLncZFHX2基因敲低导致轻度关节面磨损、滑膜炎和软骨下骨板增厚。
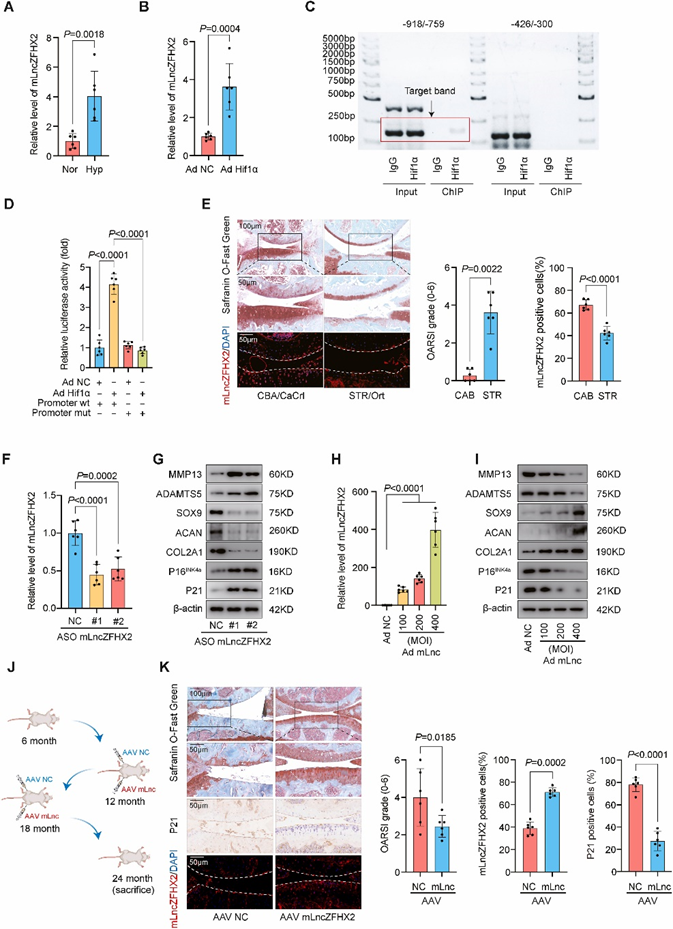
图1 mLncZFHX2在体内和体外调节骨关节炎
此外,腺病毒过表达mLncZFHX2 (Ad mLnc)上调SOX9、COL2A1和ACAN,同时下调MMP13、ADAMTS5、P16INK4a和P21(图1H)。接下来,对雄性C57BL/6小鼠进行DMM手术,然后在关节内注射mLncZFHX2 AAV或对照AAV。mLncZFHX2 AAV治疗部分抑制了dmm诱导的OA症状,但没有改善滑膜炎。最后,使用小鼠膝关节OA模型来研究mLncZFHX2是否能抑制衰老相关变性。所有小鼠的一个膝关节注射mLncZFHX2 AAV,另一个膝关节注射对照AAV(图1J)。结果表明,mLncZFHX2显著减轻老年小鼠软骨破坏(图1K)。
mLncZFHX2与KLF4形成转录复合体,调控RIF1的表达
由于mLncZFHX2主要定位于MCs的细胞核中,本工作假设mLncZFHX2可能与转录因子(TFs)联合起调节基因转录和影响OA进展的作用。对MCs进行了ChIRP分析,以研究mLncZFHX2相互作用蛋白及其在基因组中的位置。分析发现,1451个mLncZFHX2结合位点也是启动子区(fold enrichment≥7)。
为了探究mLncZFHX2是否影响基因表达,从感染Ad mLnc或对照腺病毒(Ad NC)的MCs(n = 每组3名供体)中提取总RNA。构建RNA-seq文库后,鉴定出533个潜在基因满足显著性阈值(倍数变化≥2且P < 0.05)。其中,有10个受体直接受到mLncZFHX2与其启动子结合的调控(图3A和B)。这些结果通过过表达mLncZFHX2的MCs的RT-qPCR验证(图2C)。本文还用RT-qPCR检测了WT和KO ATDC5细胞中的10个基因。RIF1在两个实验中差异最大,说明RIF1最有可能是mLncZFHX2直接调控的下游靶点。此外,ChIRP分析中DNA片段的RT-qPCR显示,mLncZFHX2富集于RIF1的启动子区(-1800至-1400)(图2D)。通过序列比对,注意到在RIF1启动子(-1323至-1313)和mLncZFHX2(82至-92)之间存在配对互补碱基。因此,得出结论,mLncZFHX2仅通过结合该序列影响RIF1的转录,而不影响其他KLF4靶基因的转录。
然后,将ChIRP分析中的所有相互作用蛋白进行银染色和质谱分析,鉴定出433种特异性偶联蛋白。对CIS-BP(在线转录因子库及其DNA结合基序)进行搜索,发现433个蛋白中有17个转录因子(图2F)。在JASPAR中筛选发现,RIF1启动子区域含有PITX1、SOX6、STAT1、JUNB、RUNX1和KLF4的推定结合位点(相对评分>0.9)。使用小抑制RNA (siRNA)和RT-qPCR敲除这6个TF发现,在KLF4敲除后,RIF1下调。
其次,通过4个实验验证了mLncZFHX2与KLF4的结合。首先,ICC和RNA FISH证实了mLncZFHX2和KLF4信号在MCs中为核信号。其次,使用单链RNA二级结构或DNA序列预测工具(RNAfold web server)预测mLncZFHX2的环结构。由于mLncZFHX2含有3个茎环结构(1-190、191-440、441-670),mLncZFHX2可能形成三级拓扑结构,介导mLncZFHX2与KLF4的结合。生物素化RNA下拉实验显示,mLncZFHX2的一个特定片段(nt 1-190)是与KLF4结合所必需的(图2G)。第三,分子对接实验发现KLF4结构域与mLncZFHX2的双螺旋发夹结构结合。对接过程中使用的KLF4的三维结构来自RCSB蛋白数据库。KLF4(苏氨酸,T;天冬氨酸,D;L赖氨酸;半胱氨酸,C;色氨酸,W;甘氨酸,G;和精氨酸,R)对mLncZFHX2的结合很重要:T401、D403、L418、L428、C432、G438、W439和L440位于表面1;表面2有L464, R467和R481(图2H)。为了阻断氢键的形成,将表面1 (mut1)上的T401、D403、L418、L428、C432、G438、W439和L440突变为丙氨酸,并将表面2 (mut2)上的L464、R467和R481突变为丙氨酸。RIP实验证实mLncZFHX2和KLF4在表面1上直接相互作用(图2I)。第四,使用RNA EMSA进一步验证了这种相互作用(图2J)。
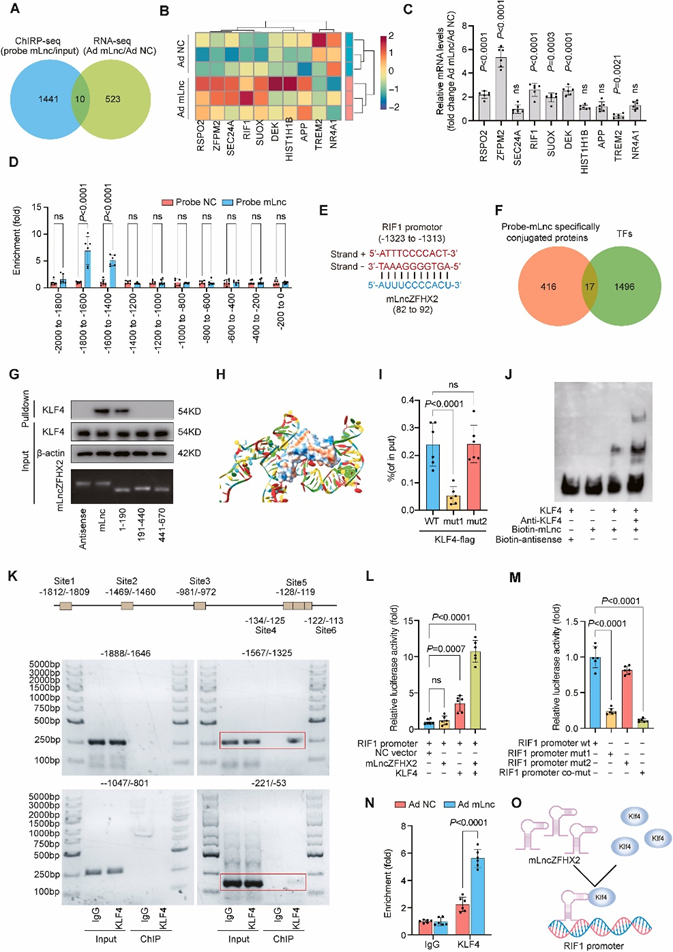
图2 mLncZFHX2通过募集KLF4到RIF1启动子上调控RIF1的表达
接下来,确定KLF4是否参与调节MCs中RIF1的表达。JASPAR预测,RIF1启动子区域包含六个假定的KLF4结合位点(图2K)。将站点4-6视为一个站点,因为它们位置近且重叠。ChIP检测结果显示,KLF4与RIF1启动子的nt-1567-1352(位点2)和nt-221-53(位点4-6)结合。然后,构建了含有RIF1启动子的荧光素酶报告质粒,并在位点2 (mut1)和位点4-6 (mut2)上构建了突变的报告质粒。荧光素酶检测证实,同时存在的mLncZFHX2和KLF4过表达促进了HEK-293细胞中RIF1的转录(图2L)。此外,观察到mLncZFHX2和KLF4都没有诱导含有mut1或共mut结合位点的报告质粒的荧光素酶活性,这表明位点2是活性启动子片段(图2M)。通过ChIP实验,证实了mLncZFHX2过表达增加了KLF4与RIF1启动子的结合(图2N)。综上所述,这些数据表明mLncZFHX2是KLF4募集的支架,可以调节RIF1的转录(图2O)。
结论:
实验进一步表明LncZFHX2调控衰老相关的细胞通路。衰老是一个复杂的过程,与多种应激刺激有关,包括端粒功能障碍、氧化应激、染色质改变、活性癌基因和DNA损伤。衰老的一个标志是线粒体功能障碍,导致细胞ROS和氧化应激升高。DNA损伤的异常积累和DNA复制也可诱发衰老。骨关节炎的特点是合成代谢(以SOX9、COL2A1、ACAN等为标志)与分解代谢(以MMP13、ADAMTS5等为标志)之间的稳态失衡。这种不平衡可能是lnczfhx2缺失细胞衰老加剧引起的继发性效应。前人的研究表明,软骨细胞衰老被认为是骨关节炎发展过程中促进基质分解代谢的关键细胞事件。此外,表达高水平P16的衰老软骨细胞也表现出软骨相关ECM蛋白(如ACAN)的低表达,但ECM降解因子(如MMP13)的表达增加。
本文验证了LncZFHX2在软骨中的富集表达。暴露于长时间的常氧环境会降低mLncZFHX2的含量,这可能是常氧环境下MCs DNA损伤反应和衰老表型的部分解释。LncZFHX2基因体外敲低可加重细胞衰老和软骨细胞OA表型。体内实验显示OA模型中lnczfhx2阳性细胞减少。由于OA早期软骨下骨破骨细胞诱导的血管形成改变了关节缺氧环境,导致软骨持续退变。破坏关节缺氧环境,提高氧分压,促进HIF-1α的降解。
RIF1是一种由2472个残基蛋白组成的大分子蛋白,具有高度结构化的N端结构域,是复杂真核生物进化的端粒复合体的一部分。该蛋白在基因组维持中起着关键作用,并参与复制时间、端粒稳态和DSB修复途径选择的调控。一项通过羟基脲、紫外光和依托泊苷诱导DNA损伤的研究检测到RIF1病灶形成,表明该标记物在DNA损伤反应信号传导中发挥作用。结合研究结果,现有数据表明RIF1是一个很有前景的治疗靶点。总之,强调了LncZFHX2在OA进展过程中DNA损伤反应中的重要作用,并证明了其作为OA和其他退行性疾病的治疗靶点的潜力。

