合作单位:Ocean University of China
参考文献:Jing Zhang, Leshan Ding, Hu Hou, Long Yu, Jing Li and Ping Dong. Journal Of Biomolecular Structure And Dynamics, 2025, 45(1): 498-504. DOI: 10.1080/07391102.2023.2283145 (IF = 2.7)
核酸是遗传信息载体,日常饮食摄入约2g核苷酸。过量摄入可能导致高尿酸血症等疾病。传统观点认为核酸消化始于小肠,但本研究团队前期发现胃蛋白酶主导胃中DNA消化。硫酸多糖(如DS)能抑制此过程,但机制不明。
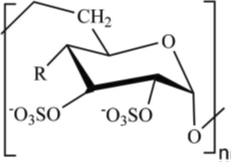
背景:
核酸作为遗传信息载体,是所有生物体的基本大分子,参与基因表达、蛋白质合成等重要生命活动。健康成人每日膳食约摄入2克核苷酸,适量核酸可促进胃肠道发育成熟、维护肠道菌群平衡(如减少沙门氏菌数量)并有益于脑、脾等器官健康;但过量摄入会导致血清嘌呤水平升高,可能引发高尿酸血症等疾病。
核酸的消化代谢是其生理功能的前提,传统观点认为其消化始于小肠,但本研究团队首次报告核酸消化可在胃中启动且主要由胃蛋白酶主导。值得注意的是,多离子化膳食多糖(如壳聚糖)能显著抑制胃蛋白酶对DNA的消化——带正电的壳聚糖通过静电作用与DNA形成复合物起保护作用;而带负电的硫酸化多糖(如硫酸葡聚糖DS)同样具有抑制效应,但其分子机制尚不清楚。本研究旨在定量解析DS抑制DNA消化的机制,这对调控核酸代谢及口服核酸药物递送具有重要意义。
方案设计:
本文分别采用体外消化实验,生物膜层干涉实验(BLI)和等温滴定量热(ITC)等实验证明DS的分子量和硫酸基团的含量对抑制胃蛋白酶消化DNA具有关键的影响。为了进一步研究DS分子与DNA的相互作用的分子机制,魔德科技采用分子模拟方法对DS分子与DNA之间的分子识别展开了深入研究。
主要结果:
本文首先采用凝胶电泳实验,系统分析了DS的分子结构特征(分子量和硫酸基含量)如何影响其对胃蛋白酶(pepsin)消化DNA的抑制作用。实验结果证明,DS能显著抑制胃蛋白酶对DNA的消化,且抑制效果依赖于其分子结构特征。硫酸基团含量越高,抑制效果越强。抑制效力排序为:DS-20H > DS-20L。表明硫酸基团是抑制活性的关键因子。

随后本文通过生物膜层干涉技术(BLI)定量分析 DS与DNA的结合动力学,探究DS分子量(Mw)和硫酸基(SO₄²⁻)含量对结合能力的影响。结果表明,DS与DNA的结合能力由其分子结构和硫酸基密度决定:高分子量、高硫酸基含量的DS结合能力更强。结果证明DS分子主要通过结合DNA形成复合物,阻断其被胃蛋白酶降解。
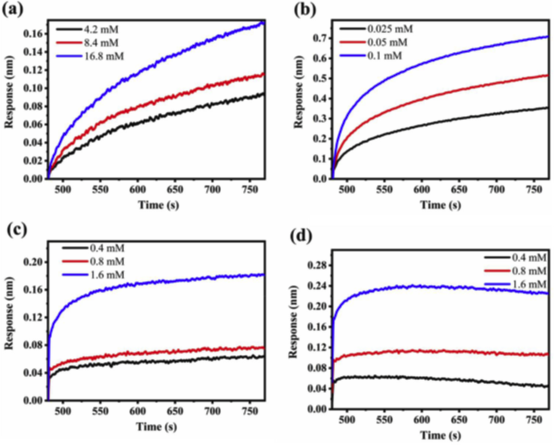
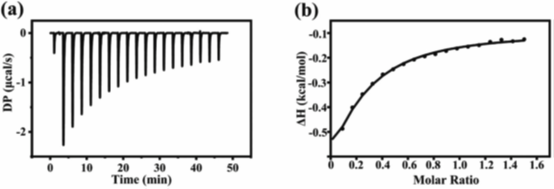
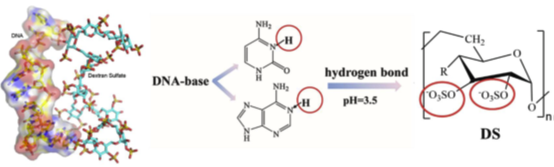
随后本文通过等温滴定量热法(ITC)定量测定DS与DNA结合的热力学参数(如结合常数Kd、焓变ΔH),揭示相互作用的能量驱动机制。DS与DNA通过弱静电作用(如氢键)结合,且该过程为放热驱动。Kd值进一步验证了BLI的结论:尽管结合力较弱,但DS通过占据DNA的酶切位点(后续分子模拟表明硫酸基与DNA碱基形成氢键),阻碍胃蛋白酶对DNA的接近和消化。
为了进一步研究和分析DS分子与DNA结合的驱动力以及相互作用的主要基团等信息,本文采用分子动力学模拟方法对DS与DNA的结合过程进行了研究。从图中可以看出,经过50 ns的MD模拟,DNA和硫酸葡聚糖从分离到稳定结合状态。
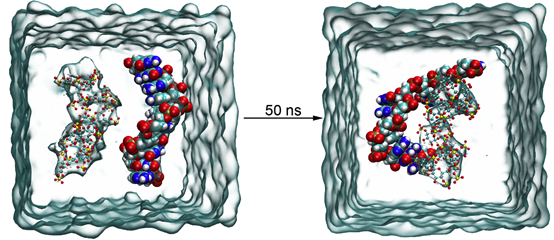
DS通过其硫酸基团与DNA碱基形成氢键网络,直接占据DNA的酶切位点,这种结合导致DNA构象变化,形成空间位阻,阻碍胃蛋白酶接近并结合DNA。另外,氢键的形成高度依赖DS分子结构中的硫酸基团的电负性和极性,这也解释了无硫酸基团的葡聚糖无抑制效果。结合模式揭示了多阴离子多糖保护DNA免于胃消化的分子基础,为开发口服核酸药物递送系统提供理论支撑。
展望
通过分子动力学模拟(MD)直观呈现了DS-DNA复合物的结合模式细节,弥补了BLI和ITC仅能提供定量参数的局限性。该结合机制可指导设计新型核酸保护载体(如优化硫酸化程度与分子量),用于治疗性核酸的口服递送或高尿酸血症干预。

