树突状细胞的分化—腐胺与STAT3的故事
合作单位:Binzhou Medical University
参考文献:Huang P, Wang M, Lu Z, et al. Putrescine accelerates the differentiation of bone marrow derived dendritic cells via inhibiting phosphorylation of STAT3 at Tyr705[J]. International Immunopharmacology, 2023, 116: 109739. doi: 10.1016/j.intimp.2023.109739.(IF=4.8)
背景:
免疫应答的启动和调节依赖于树突状细胞(DC),树突状细胞是一类造血干细胞衍生的细胞,在个体发生、组织分布和生物功能上具有异质性。个体发生研究已经确定了5个主要的树突细胞亚群:浆细胞样树突细胞、常规树突细胞、朗格汉斯细胞、滤泡性树突细胞和单核细胞来源的树突细胞(moDCs)。DC的分化、发育和功能需要特定的微环境。例如,DC在炎症微环境中可诱导,并根据肿瘤微环境的不同表现为炎症或耐受性表型。另有报道称,DC可在实验性自身免疫性脑脊髓炎、皮肤利什曼原虫中诱导Th17、Th1、Th2和Tfh反应。重度感染、屋尘螨诱发哮喘和环二GMP粘膜佐剂应答。代谢微环境在塑造免疫应答、改变免疫细胞代谢状态、触发效应功能等方面发挥着重要作用。例如,丁酸盐和黑色素瘤衍生的神经节苷类化合物同样会损害单核细胞向DC的分化。1,2-双棕榈酰- CN -甘油-3-磷脂胆碱是一种组胺结合位点抑制剂,可下调DC上特异性抗原CD80、CD86、CD11c的表达。John Hambor等研究发现,暴露于3β-羟基去氧胆酸的DC具有转录抗炎特性,并降低TNF-α和IL-6的分泌。据报道,丁酸盐和烟酸可诱导结肠巨噬细胞和树突状细胞中抗炎分子的表达,以支持Gpr109a分化Treg和IL-10产T细胞。
多胺主要由尸胺、腐胺、精胺和亚精胺组成,是各种代谢微环境中普遍存在的重要组成部分。质子化氨基的存在使多胺能够与带负电荷的DNA、RNA、蛋白质和磷脂形成静电相互作用。因此,它们在细胞增殖、分化、凋亡和迁移中发挥重要作用。近年来,多胺在自身免疫性疾病和肿瘤中的免疫调节作用引起了越来越多的关注。迄今为止,只有少数研究揭示了多胺对DC的免疫调节作用。2003年,Bella等人发现精胺浓度与乳腺癌中IL-12+ DC的比例呈显著负相关,暴露于精胺的moDCs功能受损。另外两项由Mondanelli等人于2017年和Lou等人于2020年进行的突破性研究表明,内源性和外源性亚精胺均可使DC形成ido1依赖性免疫抑制表型。同样,在Lps刺激的人树突状细胞中添加精胺或精胺可降低CD80/CD86和PDL1/PDL2的表达。腐胺是亚精胺和精胺的前体物质,其浓度往往高于其他多胺。Hardbower等人证实腐胺而非亚精胺或精胺是巨噬细胞活化的调节分子,这引起了人们对腐胺在DC中的免疫调节的兴趣。目前,腐胺免疫调节对树突状细胞的作用及其相关机制尚不清楚。
在本研究中,旨在探讨外源性腐胺对BMDCs分化和功能的影响及其机制。比较了外源性腐胺处理前后BMDC细胞标志物的表达、细胞因子的分泌、吞噬作用、抗原呈递、诱导Th反应的能力和高分辨率呼吸测量。此外,通过大量RNA测序、靶下切割和标记(CUT&Tag)测序、STAT3磷酸化特异性抑制剂、分子对接和动力学来揭示潜在的机制。综上所述,首次证明了外源性腐胺可以通过抑制STAT3 Tyr705位点的磷酸化,加速BMDCs向促炎能力降低的表型分化。研究结果可能为多胺免疫调节提供更多的见解,以及根据发病机制靶向多胺的BMDCs临床应用的独特策略。
方案设计:
为了探讨外源性腐胺对BMDCs分化和功能的影响及其机制,采用分子对接和分子动力学模拟方法研究了STAT3与腐胺化合物的分子识别过程。。
主要结果:
腐胺对脂多糖激活的BMDCs成熟的影响较小,但改变了BMDCs的功能。
如图1A所示,与无LPS组相比,在腐胺组和对照组中,LPS显著提高了MHCII、CD80、CD86和PD-L1的表达,而下调了CD172和B7H3的表达。在CD11c+细胞中,MHCII(平均差异MD = 4.13%, p = 0.004)、CD80 (MD = 2.3%, p = 0.03)、CD172a (MD = 1.53%, p = 0.03)、B7H3 (MD = – 2.56%, p = 0.03,图1B)的表达与CD11c+细胞的平均荧光强度(MFI)的观察结果(图4)有统计学意义但差异较小。为进一步检查,采用同种异体MLR检测使用细胞计数试剂盒-8 (CCK8)检测分析T细胞增殖。结果显示,与对照组(OD = 1.03±0.11,p = 0.0022,图1D)相比,腐胺组脾CD4+ T细胞增殖明显受损(OD = 0.79±0.04)。此外,对MLR上清液中的细胞因子水平进行了分析(图1E)。与对照组相比,腐胺组IL-4、IL-10水平显著上调,IL-6、IFN-γ水平下调。各组间IL-2、TNF-α水平差异无统计学意义。鉴于小鼠Th2细胞产生IL-10和IL-4,进一步研究CD4+GATA3+细胞在CD4+ T细胞中的比例,腐胺组(11.18±0.56%)较对照组(7.73±0.41%)显著增加(图1F)。
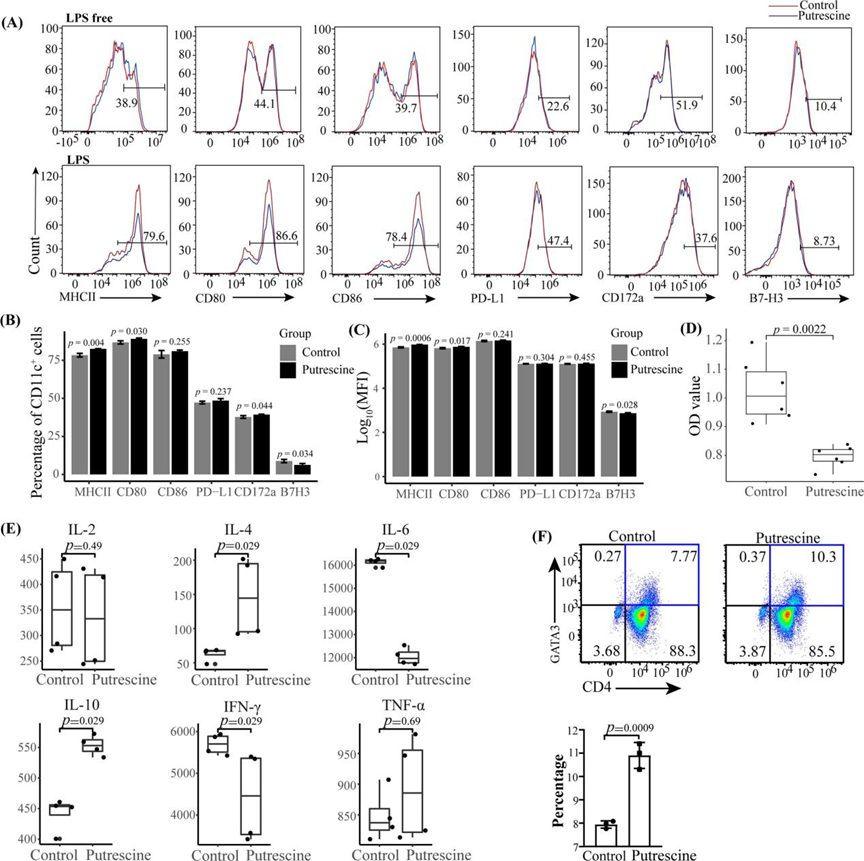
图1 腐胺对成熟BMDCs中MHCII及共刺激分子表达的影响
腐胺可能通过抑制STAT3的Tyr-705磷酸化来调节BMDCs
上述观察结果表明,腐胺主要通过加速BMDCs分化来影响BMDCs,而抑制Tyr-705磷酸化STAT3可能在腐胺对BMDCs的免疫调节中起重要作用。因此,进一步的研究基于腐胺可能主要在分化阶段通过抑制STAT3的Tyr -705磷酸化来调节BMDCs的假设。首先利用p-STAT3特异性抑制剂(Stattic)检测抑制Tyr-705对STAT3的磷酸化是否会导致BMDCs与腐胺诱导的表型相似。大于2.5 μm的stattic诱导BMDCs失败,导致细胞死亡,而0.5 μm的static极大地抑制了STAT3的tyrr -705磷酸化(Fig. 2A),但不影响BMDCs的诱导。采用流式细胞术评估未成熟BMDCs的分化效率(图2B),结果显示,与对照组相比,静态组和腐胺组CD11c+CD80+、CD11c+CD86+和CD11c+MHCII+CD80+CD86+细胞的百分比更高。同样,在评估未成熟BMDCs的线粒体呼吸时也观察到类似的趋势(图2C)。此外,根据上述观察(图2E), stattic和腐胺有降低BMDCs中TNF-α和IL-2分泌的趋势(图2D)。
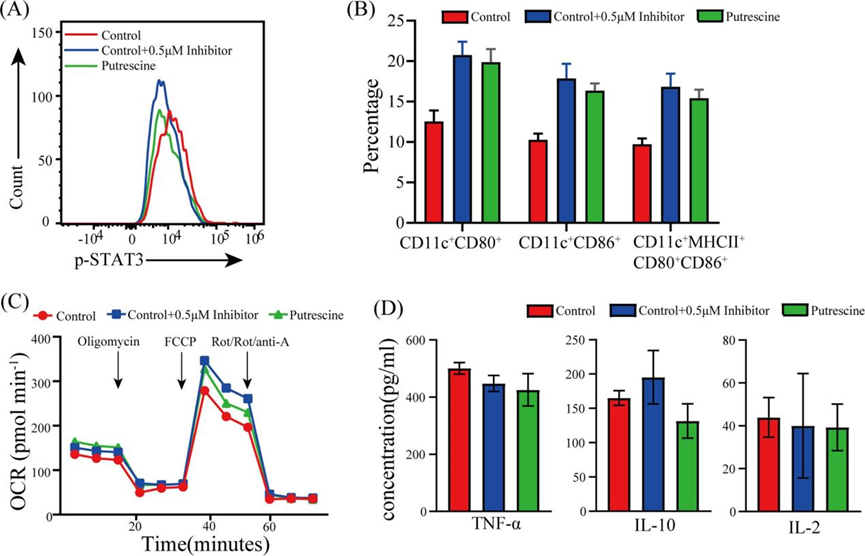
图2 p-STAT3特异性抑制剂(Stattic)对BMDCs的影响
然后进行分子对接和分子动力学,探讨腐胺如何抑制STAT3的Tyr-705磷酸化。采用均方根偏差(RMSD)和旋转半径(Rg)测量腐胺与STAT3配合物的稳定性(图3a和b)。60 ns后的稳定RMSD(1.221±0.080 nm)和Rg(5.116±0.062 nm)表明在模拟过程中腐胺和STAT3的复合结构达到了稳定状态,模拟中获得的轨迹可用于下游分析。采用溶剂可及表面积(SASA)来评估腐胺偶联对STAT3结构的影响(图3C)。60 ns后,SASA降低,稳定值为728.385±5.500 nm2,表明蛋白质与周围溶剂的相互作用减弱,从而增强了STAT3结构的稳定性。均方根波动(RMSF)可以表征蛋白质中氨基酸残基的柔韧性。如图3D所示,Stat3 -腐胺配合物较灵活的区域主要分布在两条链的N端。此外,腐胺与Glu594、Arg609、Ala703、Pro704、Tyr705组成的亲水空腔通过与Glu594、Ala703形成氢键结合(图3E)。在Multiwfn软件中基于独立梯度模型进一步分析腐胺与周围氨基酸残基之间的弱相互作用,同时发现腐胺与Tyr705之间存在C-H…π相互作用(图3F)。此外,腐胺与STAT3之间的氢键相互作用次数在1 ~ 4之间波动,60 ns后平均为1.94次(图6G)。在整个分子动力学过程中,lj电位稳定(-33.867±10.975 kJ/mol),而60ns后,Coul电位在-176.462±62.891 kJ/mol上下波动,表明腐胺与STAT3之间的静电相互作用强于范德华相互作用(图3H)。综上所述,腐胺可以稳定地结合到STAT3的亲水腔上,并对Tyr705的磷酸化有显著影响。
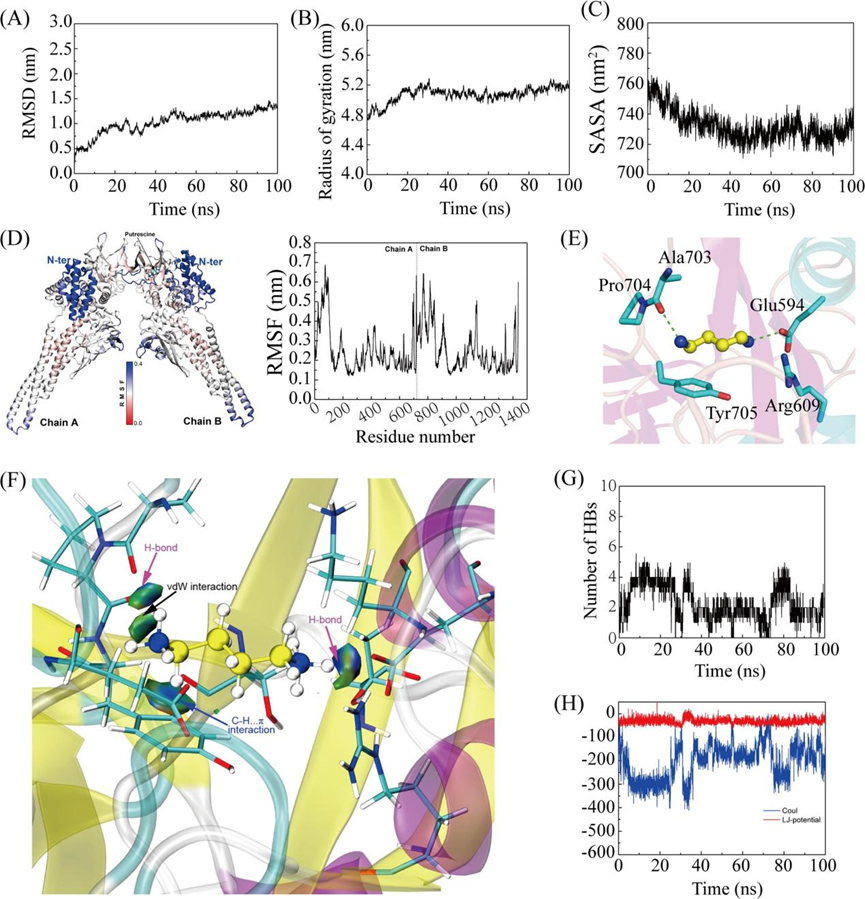
图3 腐胺与STAT3偶联的分子对接及分子动力学研究
然后进行CUT&Tag测序以揭示腐胺引起的p-STAT3(Tyr705)与DNA之间相互作用的改变。理论上,靶向CUT&Tag的转录因子主要产生核小体大小的片段(~ 180bp)和可变数量的较短片段。本研究中绘制的片段大小分布峰值在200 bp左右,表明CUT&Tag实验成功(图4A)。此外,两组之间STAT3的基因组占用率没有显著差异(图4B)。在这些结合位点中,进一步的峰注释显示,对照组中43.18%、32.78%和16.50%的STAT3结合位点分别位于远端基因间区(TSS下游10 kb)、内含子和启动子区域,而腐胺组中这一比例分别为42.79%、33.82%和16.40%,表明STAT3可以通过与远端调控元件结合来调控基因(图4C)。最近的一项研究报告了类似的观察结果。此外,根据不同样本中峰的归一化丰度,PCA在前两个轴上具有97%的方差,表明对照组和腐胺组之间存在离散聚类(图4D),这与上面转录组谱的观察结果一致(图3A)。基于HALLMARK数据库的GSEA显示,与对照组相比,腐胺组IFN- γ响应(NES =, pvalue =)下调,p53通路(NES = 1.95, pvalue = 0.006)上调(图4E)。未检测到显著富集,内含子峰位于内含子内或远端基因间。DNA基序分析显示,与对照组的“TTNCCCTNTTNA”和“CAGGGCCTGGGA”基序相比,腐胺组的p-STAT3(Tyr705)识别了可变的DNA基序(图4F)。
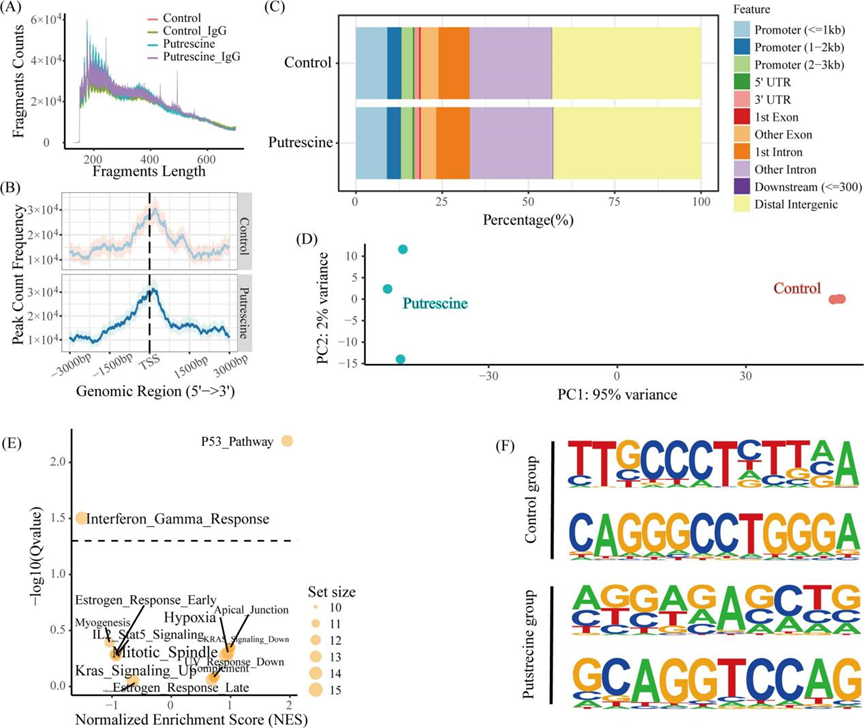
图4 CUT&Tag分析:p-STAT3(Tyr705)与DNA之间的相互作用
结论:
树突状细胞(DC)在免疫应答中起着关键作用。DC的分化和功能受环境代谢物的调节。腐胺普遍存在于各种代谢微环境中,其免疫调节作用已引起越来越多的关注。然而,与DC诱导的免疫调节相关的机制尚不清楚。在这项研究中,发现腐胺促进了未成熟骨髓源性DC(BMDC)的诱导,同时增加了未成熟BMDC的吞噬和迁移,并改变了细胞因子的分泌。转录组学分析显示炎症相关通路明显受损,氧化磷酸化升高,p-STAT3 (Tyr705)表达降低。此外,腐胺对脂多糖(LPS)诱导的BMDCs成熟影响较小,但显著损害了脂多糖诱导的DC诱导的异体T细胞增殖和细胞因子分泌。此外,对腐胺与STAT3偶联的分子对接和动力学研究表明,腐胺可以稳定地结合到STAT3的亲水腔上,并对Tyr705的磷酸化产生显著影响。CUT&Tag分析发现,与对照组相比,腐胺组的基序改变,IFN-γ反应下调,p53通路上调。总之,研究结果首次证明腐胺可能通过抑制STAT3 Tyr705位点的磷酸化来加速BMDCs的分化。鉴于树突状细胞和腐胺在各种免疫反应和发病机制中都具有普遍而独特的作用,研究结果可能为多胺对树突状细胞的免疫调节提供更多的见解,并为临床利用多胺靶向树突状细胞提供不同的策略。


