合作单位:Guangdong Medical University
参考文献:Feng Chen, Yanting Chen, Huiyi Chen, et al. 2021. DOI:https://doi.org/10.21203/rs.3.rs-380304/v1
背景:
阿尔茨海默病(AD)是最常见的一种神经退行性疾病。载脂蛋白E (APOE)作为中枢神经系统中主要的脂质转运蛋白,具有免疫调节、信号转导、维持突触连接等多种功能。研究证明,APOE基因的ε4等位基因是迟发性AD最强的遗传危险因素,其蛋白产物APOE4对包括阿尔茨海默病在内的各种与认知障碍相关的疾病具有有害作用。相对于风险中性ε3等位基因,该病的早期发展呈基因剂量依赖性。研究表明,APOE4部分通过其突触损伤影响这些疾病。
突触传递依赖于突触囊泡与突触前膜的融合。在突触前末梢,分泌的神经递质需要与可溶性N-乙基马来酰亚胺敏感因子结合蛋白受体(SNARE)紧密协调的膜融合机制。在突触中,SNARE蛋白主要包括囊泡相关蛋白(v-SNARE)VAMP2、质膜t-SNARE蛋白和突触相关蛋白等。SNARE复合物形成的畸变与认知功能高度相关。研究表明,在AD患者死后的大脑中,SNARE复合物的形成明显减少。作为神经退行性疾病和认知功能障碍的重要危险基因,不同APOE基因型与SNARE之间的相关机制尚不清楚,APOE是否会影响SNARE的组装还有待进一步研究。
方案设计:
经与魔德科技(www.modekeji.cn)技术团队沟通,拟通过分子对接和分子动力学分析,阐明APOE3与APOE4在VAMP2结合能力上的差异的分子机制。
主要结果:
均方根偏差( RMSD)用来衡量APOE-VAMP2复合物体系的稳定性(图a)。在模拟开始时(0- 20 ns), RMSD值相似,这主要是由于蛋白质与周围水溶剂相互作用导致蛋白质结构波动较大。模拟50 ns后,RMSD参数急剧增加,并保持稳定。整体来讲,模拟过程中APOE4-VAMP2复合物的RMSD值较低,表明该蛋白复合物比APOE3-VAMP2复合物更稳定。
回转半径(Rg)用于表征蛋白质结构的紧密程度(图b)。在模拟的前20ns,两个复合物的Rg值逐渐下降,这主要是由于在模拟过程中vamp2的α-螺旋逐渐向APOE蛋白靠近,两个系统的结构变得更加紧凑。APOE4-VAMP2体系的平均Rg值较APOE3-VAMP2小,说明VAMP2与APOE4形成的体系比APOE3更紧密,因此,推测相互作用可能更强。
通过分析APOE蛋白与VAMP2之间的氢键数量和结合能(图c、d),可以发现APOE4与VAMP2之间的氢键数高于APOE3,APOE4和VAMP2之间的结合能平均值低于APOE3和VAMP2结合能平均值,表明二者的亲和力也更强。
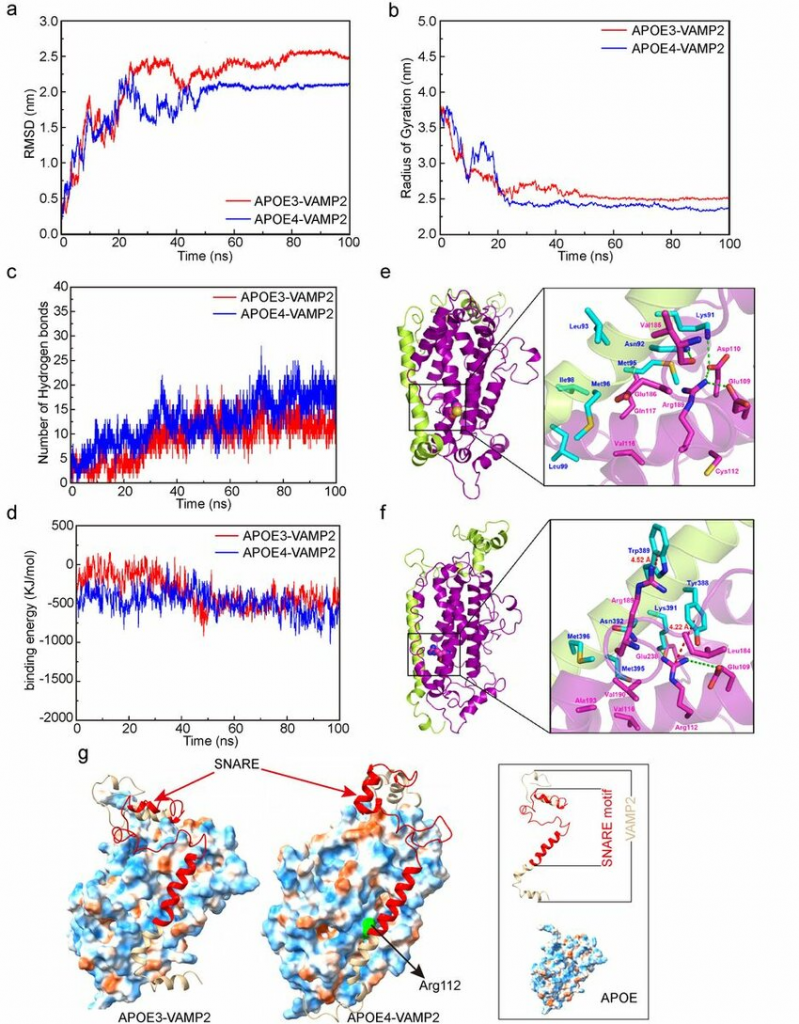
图1 APOE3-VAMP2和APOE4-VAMP2APOE2-VAMP2体系的RMSD(a)和Rg(b)随MD模拟时间的变化;APOE蛋白与VAMP2之间氢键数量(c)和结合能(d)随MD模拟时间的变化;APOE3(e)和APOE4(f)与VAMP2的结合模式(绿色和红色虚线分别表示氢键作用和cation-π作用);VAMP2在APOE3和APOE4蛋白表面的结合模式(g)(cartoon模型表示VAMP2,红色区域表示与Snap25、Syntaxin蛋白形成SNARE复合物的区域,APOE3和APOE4用surface模型表示,蛋白表面蓝色和橙色区域分别表示亲水和疏水区域)
APOE3 (Cys112)和APOE4 (Arg112)仅在112位的一个氨基酸残基上有所不同,这已被证明可以显著改变APOE蛋白的结构和功能。为了进一步研究1 12位氨基酸突变引起的与VAMP2结合的差异,分析了MD后APOE蛋白112位附近的氨基酸构象(图e、f)。分子间相互作用的详细分析表明,Cys112侧链在APOE3和VAMP2的结合中没有明显作用。
在APOE4与VAMP2的结合模式下,Arg112侧链转向VAMP2蛋白,与Glu109形成氢键,与VAMP2结构中的芳香氨基酸Tyr88形成阳离子–π相互作用。Arg112与芳香环质心的距离为4.22 Å。此外,APOE4中的Arg189与VAMP2的Trp89形成阳离子-π相互作用,Arg189主链与asn92、Glu238、Lys91之间存在氢键相互作用,进一步增强了APOE4与VAMP2的结合亲和力。
为了进一步研究APOE基因型与VAMP2蛋白结合的差异,分析了APOE和VAMP2蛋白的结合方式(图g)。VAMP2蛋白主要依赖于α-螺旋结构与APOE蛋白的亲水性凹槽结合。因此,可以推断亲水性相互作用是分子识别过程中的关键作用力之一。此外,VAMP2和apoe蛋白结合表面附近存在一些疏水区域,疏水相互作用可进一步增强蛋白结合。负责SNARE复合物形成的VAMP2区域可以完全结合APOE蛋白,从而进而影响VAMP2与其他蛋白质形成SNARE复合物。
结论:
分子对接和分子动力学分析表明,APOE4-VAMP2复合物比APOE3-VAMP2更稳定,氢键数目更多,且具有更高的亲和力。这阻碍了VAMP2形成SNARE复合物,从而导致APOE4诱导的突触功能障碍。进一步的体外和体内实验结果也表明,APOE4阻断SNARE复合物组装,负向调节突触囊泡释放,最终导致突触损伤和认知障碍。本文研究结果为易感基因APOE的分子机制提供了新的见解。