合作单位: Qingdao Agricultural University
参考文献:Yanxiang Zhao, Mengyu Chi, Hunlin Sun, et al. Phytopathology. 2021;111(8):1420-1427. DOI:10.1094/PHYTO-09-20-0431-R(IF = 4.025)
本研究探讨了禾谷镰刀菌FgCYP51B蛋白Y123H突变对分生孢子和子囊孢子发育以及对丙氯嗪的敏感性的影响。结果表明,Y123H突变导致分生孢子数量减少,影响子囊孢子的发育,并且降低了对丙氯嗪的敏感性。这些结果将进一步引起人们对禾谷镰刀菌潜在的抗药性突变的关注,并进一步加深我们对抗药性机制的认识。
背景:
小麦赤霉病(Fusarium Head Blight, FHB)是一种由镰刀菌属真菌引起的植物疾病,也是中国小麦的主要病害。其中,禾谷镰刀菌(Fusarium graminearum)是最主要的致病菌。由于对全球粮食生产和食品安全的重大影响,禾谷镰刀菌被分子植物病理学期刊列为十大植物真菌病原体之一。
目前,使用杀菌剂对小麦进行喷雾防治是预防FHB最有效的方法。常用的杀菌剂有苯并咪唑类杀菌剂(MBCs)、甾醇脱甲基抑制剂(DMIs)等。DMIs的靶标蛋白是病原真菌的甾醇-14α-脱甲基酶(CYP51)。其作用机理主要是通过抑制该酶的活性阻断真菌细胞膜主要成分麦角甾醇的合成,同时造成大量有害中间产物的积累,破坏细胞膜的结构与功能。但是由于长期大量的使用,现已产生了对这些杀菌剂耐药的菌株。
研究表明,氨基酸点突变是植物病原菌对 DMIs产生抗性的主要机制。目前尚不清楚禾谷镰刀菌的Y123突变体是否具有抗丙氯嗪(PRO)能力。因此,本文通过定点突变技术将CYP51B的第123位酪氨酸改变为组氨酸,产生了一个单点突变体。旨在探讨Y123H突变对菌落形态和生长速率、分生孢子产量的影响,并探讨禾谷镰刀菌中Y123H突变是否具有抗丙氯嗪的作用,并分析其分子机制。
方案设计:
经与魔德科技(www.modekeji.cn)技术团队沟通,拟采用分子模拟方法对模建得到的FgCYP51B及突变体和PRO进行了分子识别和耐药机制的探究。
主要结果:
分别将PRO对接FgCYP51B和FgCYP51B-Y123H突变体的催化活性中心,得到的结合能分别为-6.23和-6.05 kcal/mol,从能量方面来看, Y123H与PRO之间的亲和力相比野生型有所降低,表明该突变位点可能会使PRO与酶的亲和力降低。
为了进一步研究PRO与酶结合的主要驱动力,图1分别给出了PRO在FgCYP51B和FgCYP51B-Y123H突变体活性中心的结合构象,从图中可以看出PRO结构中的疏水性基团结合在酶活性位点的强疏水空腔内,与周围的环境形成了很强的疏水相互作用。而PRO的吡唑N原子在空间位置上靠近HEME的Fe原子,与文献中的报道相一致, 这也证明了分子对接结果的可靠性。
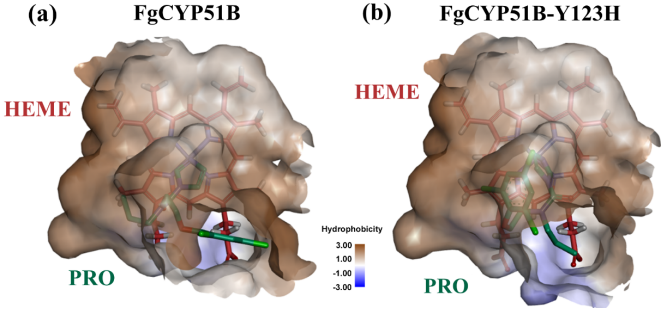
图1 PRO与FgCYP51B和FgCYP51B-Y123H突变体活性位点的结合模式(绿色stick表示PRO,红色stick表示HEME,褐色表示疏水表面,蓝色表示亲水表面)
为了具体分析参与二者识别的关键氨基酸,对二者的结合模式进行了进一步分析。如图2所示,总体来讲,PRO与FgCYP51B和FgCYP51B-Y123H的结合模式差别不大,主要是疏水性氨基酸残基参与了分子识别,主要有Phe131、Vel136、Tyr137、Phe230、Ala304、Ile374和Phe511,这些疏水性很强的氨基酸残基为HEME鳌合PRO提供了一个极强的疏水性环境,有利于分子识别过程的顺利进行。这是PRO与FgCYP51B及突变体普适的结合模式。
另外,FgCYP51B突变体与野生型相比,Tyr123突变成非疏水性的组氨酸,会削弱PRO与FgCYP51B的疏水作用,导致PRO与酶的亲和力降低(结合能降低0.18 kcal/mol)。因此,从结合模式上来讲,PRO与FgCYP51B-Y123H突变体的结合能力更弱。
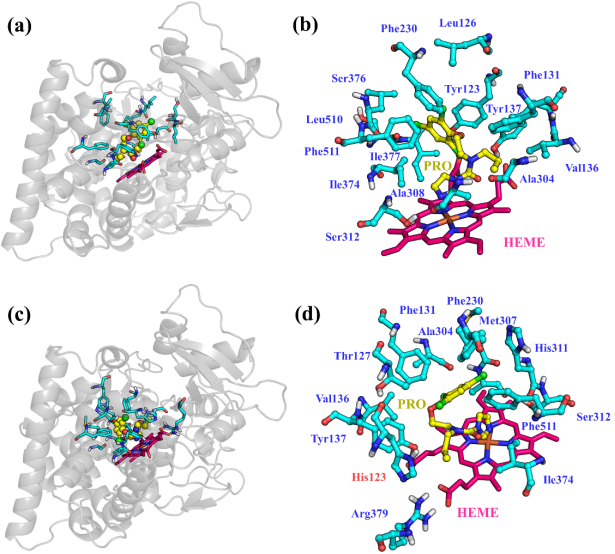
图2 PRO与FgCYP51B和FgCYP51B-Y123H突变体的结合模式(a和b表示PRO与FgCYP51B的结合模式,c和d表示PRO与FgCYP51B-Y123H的结合模式。蓝色ball表示参与结合的氨基酸残基,黄色stick表示PRO,粉色stick表示HEME,酶的二级结构用灰色cartoon表示)
为了深入研究FgCYP51B野生型和突变体与PRO亲和力不同的主要原因,本文对PRO与各个体系结构中HEME的Fe原子的距离,以及Y123在突变前到抑制剂苯环的距离进行了分析,如图3所示。从图中可以看出,在FgCYP51B中,抑制剂与铁原子的距离为2.6 Å;且Y123到苯环的距离为3.5 Å,二者形成了较强的π-π相互作用。而在突变体中,虽然化合物中的N原子到Fe原子的距离为2.2 Å,但由于His123侧链结构中不存在较强的疏水基团,导致抑制剂中的苯环发生扭转,倾向于与Phe131形成π-π作用。因此PRO与Y123H突变体的亲和力降低,抑制活性下降。
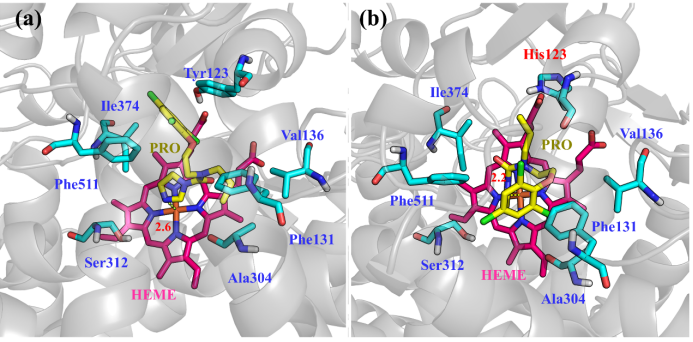
图3 PRO中吡唑氮原子在FgCYP51B和FgCYP51B-Y123H中与HEME中Fe原子的距离及Y123突变前后到PRO苯环的距离(黄色虚线表示PRO到HEME中Fe原子的距离,灰色虚线表示Y123到PRO间的距离)


