合作单位:Fuwai Hospital
参考文献:Peng Fan, Yiting Lu, Kunqi Yang et al. Endocrine, 2020. DOI: 10.1007/s12020-020-02460-9 (IF=3.925)
本文旨在鉴定中国AME家族中HSD11B2的新型复合杂合突变。构建了11βHSD2的计算模型来评估基因型-结构-表型的相关性,总结了与HSD11B2突变丧失功能相关的AME患者的临床特征。
背景:
表观盐皮质激素过多(apparent mineralocorticoid excess,AME)是一种罕见的常染色体隐性遗传病,由HSD11B2突变引起的Ⅱ型11β-羟基类固醇脱氢酶(11βHSD2)基因缺陷所致。11βHSD2在皮质醇对可的松的外周失活中起重要作用,从而保护盐皮质激素受体(MR)免受皮质醇的不适当激活。HSD11B2突变导致11βHSD2酶缺乏,导致过度的皮质醇刺激MR,引起强烈的水和钠潴留,低钾血症和高血压。本研究的目的是在中国AME家系中鉴定新的复合杂合HSD11B2突变,并对与HSD11B2突变相关的AME临床特征进行系统评价。
方案设计:
本研究在一个中国家庭的HSD11B2中发现了与AME相关的新的复合杂合突变(c.343_348del和c.1099_1101del),该突变造成Glu115/Leu116和Phe367缺失。先证者的症状表明这些突变是导致AME的原因。目前晶体结构数据库中没有Glu115/Leu116和Phe367缺失突变体蛋白的结构数据,因此为了深入研究蛋白的结构与功能的关系,经与魔德科技(www.modekeji.cn)技术团队沟通,拟采用同源模建方法对HSD11B2突变体蛋白的结构进行预测。
主要结果:
通过同源模建方法,构建了HSD11B2蛋白的三维结构模型。利用Ramachandran plot和Verify 3D评估了模建结果的合理性,并作为后续研究的模板。图1给出了蛋白的结构及Glu115/Leu116和Phe367缺失突变点的位置。从图中可以看出,Glu115/Leu116靠近NADP结合位点,可以与其形成相互作用,另外还与Asn117形成了氢键作用。Leu116的侧链与Leu134、Leu135、Met137形成了较强的疏水相互作用。Phe367距离NADP不远,Phe367可以与Phe362形成氢键作用,其侧链疏水性的苯环可以与周围的氨基酸残基形成较强的疏水作用。
因此缺失突变体Glu115/Leu116和Phe367不仅可能干扰附近氨基酸残基之间的相互作用,也可以影响NADP的稳定性以及底物结合的稳定性,进而导致酶的活性功能丧失。
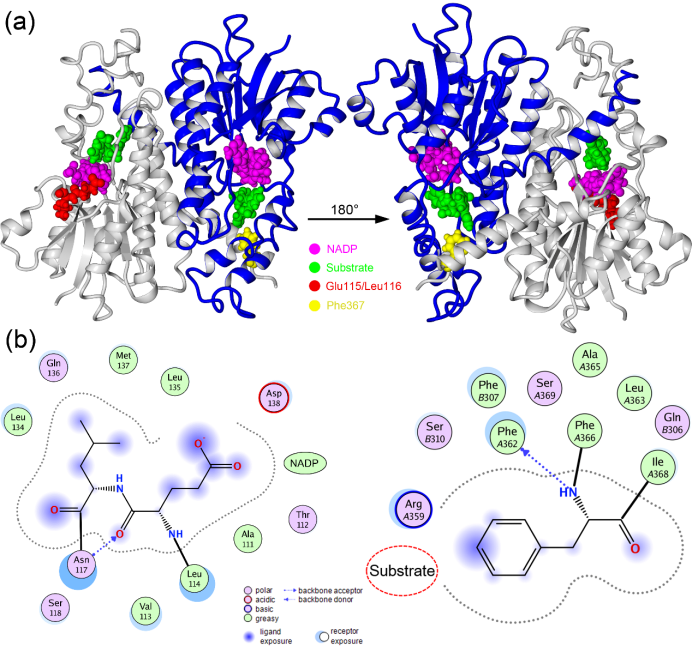
图1 HSD11B2蛋白模型及突变位点信息(a:蛋白整体结构及辅酶、底物和突变位点信息;b:Glu115/Leu116和Phe367与周围氨基酸残基及底物的相互作用情况)

