合作单位:The Engineering Research Institute of Agriculture and Forestry
参考文献:Zhizhong Song, Bin Peng, Zixia Gu, et al. Horticulture Research, 2021.
DOI:10.1038/s41438-021-00461-x(IF = 7.29)
背景:
果实香气作为风味的一种嗅觉成分,是评价果实品质的重要指标。不同水果的独特香气取决于它们的挥发性化合物。在桃果中,由PpAAT1催化的γ–癸内酯(γ-decalactone)是最重要的挥发性化合物,负责果实的特征香气。PpAAT1属于植物BAHD酰基转移酶超家族,PpAAT1可以催化4-羟基癸酰辅酶A的羟基(-OH)和酰基辅酶基团(-COA)的内酯化反应以及醇与酰基辅酶之间的酯化反应。
方案设计:
为探讨PpAAT1催化4-羟基癸酰辅酶A内酯化以及醇与酰基辅酶之间酯化反应的关键氨基酸残基。经与魔德科技(www.modekeji.cn)技术团队沟通,拟采用分子对接和分子动力学模拟方法对其进行进一步研究。
主要结果:
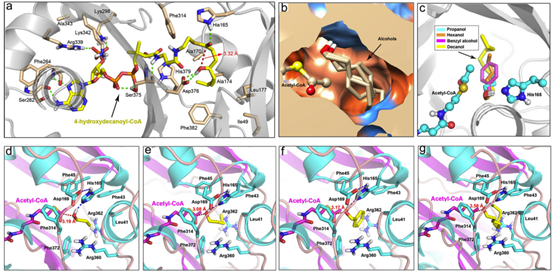
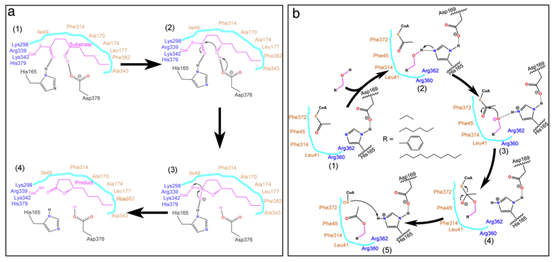
据预测,PpAAT1共有16个氨基酸残基参与了γ-癸内酯的生物合成(图1a)。为了鉴定在酯化反应中参与酶–底物识别的氨基酸,乙酰辅酶A和四种醇(丙醇、己醇、苯甲醇和癸醇)对接在PpAAT1的活性中心形成结合构象(图1b)。共鉴定出9个可能参与乙酰辅酶A与醇之间酯化反应的候选氨基酸残基(Leu41、Phe43、Phe45、His165、Asp169、Phe314、Arg360、Arg362和Phe372)(图1d-g)。在PpAAT1 –醇–乙酰辅酶A复合物中,羟基位于乙酰辅酶A和氨基酸残基His165之间(图1c)。其中残基His165和Phe314既参与了γ-癸内酯的合成也参与了乙酰辅酶A与醇的酯化反应。
30 ns后,PpAAT1与4-羟基癸酰辅酶A复合物在动力学模拟过程中没有出现明显的波动(图2a, b)。内酯化及酯化反应体系的平均RMSD值表明PpAAT1-配体配合物在分子动力学模拟(MDS)过程中达到了稳定。
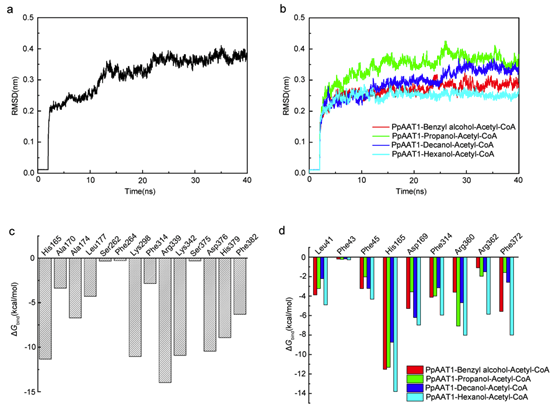
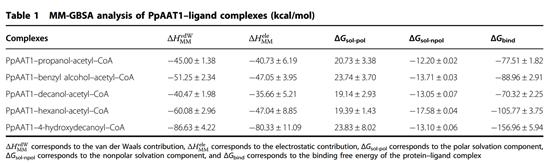
采用MM-GBSA方法计算了范德华(vdW)、溶剂化(极性和非极性)和静电相互作用对PpAAT1—配体配合物相对结合自由能(ΔGbind)的贡献(表1)。结果表明,vdW值对各配合物的总自由能贡献最大。为了进一步了解PpAAT1中影响底物结合的关键氨基酸残基的自由能,利用MM-GBSA方法对ΔGbind进行了分解。结果表明,在内酯化及酯化反应中,氨基酸残基His165、Lys298、Arg339、Lys342、Asp376和His379对底物结合的贡献大于Ser262、Phe264和Ser375, His165对底物结合的贡献大于Phe43(图2c, d)。
之前的研究表明,在PpAAT1中替换Ile49和Ala343导致低香气桃品种的γ-癸内酯产量下降。因此,在本研究中替换了剩余的14个可能参与内酯化反应的候选氨基酸残基和9个可能参与酯化反应的候选氨基酸残基,评估可能参与PpAAT1内部酯化及酯化反应的每个候选氨基酸残基的功能。
在大肠杆菌中异种表达PpAAT1及其位点定向突变蛋白(PpAAT1-SMS),并在体外研究了纯化后的PpAAT1和PpAAT1- SMS在4-羟基癸酰辅酶A为底物的内酯化反应中的酶活性。在14个候选氨基酸残基中,S262、F264和S375的取代对相应PpAAT1-SMS的酶活性、亲和力(Km值)和酶效率(Kcat/Km)没有显著影响。然而,参与内酯化反应的另11个候选氨基酸残基被取代后,相应的PpAAT1-SMS的酶活性显著降低,Km值显著增加,Kcat/Km降低。尤其是H165和D376的取代,导致酶活性完全丧失(图3),位点定向突变蛋白的Km值和Kcat/Km无法检测。酶动力学分析也得到了一致的结果。
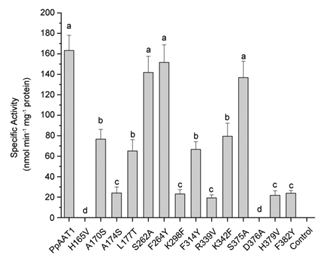
以乙酰辅酶A和四种不同的醇(丙醇、己醇、苯甲醇和癸醇)为底物,对可能参与酯化反应的9个候选氨基酸残基的功能进行了研究。其中,F43的替代对位点定向突变蛋白的Kcat/Km比率没有任何显著影响。然而,所有其他8个候选氨基酸残基的替换显著降低了定点突变蛋白的Kcat/Km比率,尤其是H165的替换,导致定点突变蛋白的Kcat/Km比率无法检测。MM-GBSA结果显示,PpAAT1 -己醇-乙酰辅酶A配合物的相互作用能比另三种配合物的相互作用能更稳定,与此一致的是,以己醇为底物时,所有取代物的Kcat/ Km比都更高。 综上,研究结果表明,在PpAAT1中,H165和D376两个残基都是内酯化反应所必需的,而在酯化反应中,H165是必需残基。在PpAAT1的内酯化反应中,残基H165和D376直接与底物相互作用,其余11个氨基酸残基在反应中心起底物识别和空间构象的作用。最初,His165指向羰基,而Asp376指向羟基。然后,底物羟基上的氢原子被转移到Asp376的羧基上,形成芳香核。最后,去除辅酶A – SH基团,形成最终的内酯产物(图4a)。在PpAAT1的酯化反应中,羟基与His165形成氢键,然后攻击乙酰辅酶A的乙酰C原子形成酯(图4b)。
总结:
本文采用分子对接与位点定向诱变相结合鉴定了桃果香气生物合成中醇酰基转移酶PpAAT1的关键活性位点残基,可用于指导桃果新品种的分子选育,保持和改善桃果风味。


