合作单位:Northwest A & F University
参考文献:Jie Zhang, Ning Zhao, Junnan Xu, et al. Enzyme and Microbial Technology, 2021.
DOI:10.1016/j.enzmictec.2021.109814(IF=3.7)
看点:本文首次对酒球菌SD-2a中新型β-葡萄糖苷酶BGL0224的催化机理进行了探讨,对开发其在食品工业中的潜在应用具有重要意义。
背景:
β-葡萄糖苷酶(EC3.2.1.21)是一种广泛存在于自然界的纤维素酶,可以从植物、动物和微生物中提取。不同来源的β-葡萄糖苷酶的结构和酶学性质差别很大。β-葡萄糖苷酶的主要功能是水解糖苷键,释放β- D -葡萄糖苷残基。在各种β-葡萄糖苷酶中,微生物衍生的β-葡萄糖苷酶因其可大规模制备、价格低廉、环境友好等优点,越来越受到工业应用的青睐。β-葡萄糖苷酶对许多生物过程至关重要,此外,还被认为是一种多功能的工业生物催化剂。与其他工业催化剂相比,β-葡萄糖苷酶的稳定性显著提高,避免了酶亚基脱附。β-葡萄糖苷酶还能水解多种糖苷,对提高食品的香气和品质具有重要意义。研究β-葡萄糖苷酶的催化机理,有助于提高纤维素水解的催化效率。
方案设计:
酒球菌SD-2a作为一种专利菌株,在葡萄酒发酵过程中发挥着重要的作用,其最重要的原因是其高β-葡萄糖苷酶活性。对酒球菌β-葡萄糖苷酶的研究多集中在初步表征上,对其催化机理的研究报道较少。作者先获得了新型β-葡萄糖苷酶BGL0224,并成功表征了其酶学性质。为深入研究酒球菌SD-2a的β-葡萄糖苷酶,经与魔德科技(www.modekeji.cn)技术团队沟通,拟采用同源模建(Homology modelling),分子对接(Molecular docking)和分子动力学(Molecular dynamics, MD)模拟方法,对β-葡萄糖苷酶催化底物的作用机制进行研究。
主要结果:
对β-葡萄糖苷酶BGL0224进行同源模建,从而获取目标蛋白合理的三维结构模型。综合Ramachandran plot和Verify 3D程序评分,可知构建得到的蛋白结构是合理的,可作为后续研究的模板。
为验证复合体系BGL0224-pNPG的稳定性,本文采用分子对接的复合物结构进行了50 ns的MD模拟。均方根偏差(Root mean square deviation,RMSD)表示某一时刻的构象与目标构象所有原子偏差的加和,是衡量体系是否稳定的重要依据。回转半径(Radius of Gyration, Rg)可以用来描述整体结构的变化情况,Rg变化越大表明体系越膨胀。复合物体系的RMSD在40 ns后基本趋于平稳。由于复合物在模拟过程中的溶剂化作用,体系的Rg值在模拟过程中逐渐增大,也在40 ns后趋于稳定。均方根涨落(Root mean square fluctuation, RMSF)可以表示蛋白质中氨基酸的柔性大小,柔性越大的的氨基酸在模拟过程中RMSF值越大。根据计算结果,大部分氨基酸的RMSF值在0.2以下,说明BGL0224的整体柔韧性较低。
对MD模拟过程中蛋白内部的氢键数目和蛋白与底物之间的氢键进行计算统计表明,蛋白内部的氢键数目在模拟过程中基本稳定在360个左右,而底物与酶之间的氢键数目在40 ns趋于稳定,约为4个。酶和底物的氢键数在MD模拟过程中基本保持稳定,表明复合物的结构未发生较明显的变化。
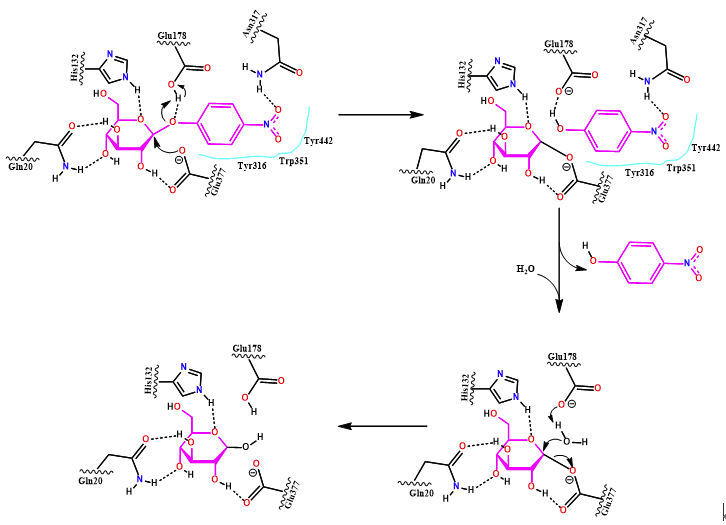
根据MD模拟轨迹,对β-葡萄糖苷酶与底物之间的结合能进行了计算。从图1中可以看出,结合能主要由库伦作用力和LJ势能组成,两种能量对于结合能的贡献大小基本一样。复合体系的结合能在前20 ns波动较大,40 ns后基本趋于稳定,结合能为-202.00±20.72 kJ/mol。
为了进一步分析β-葡萄糖苷酶与底物结合的相互作用,提取了MD模拟之后的复合物结构进行了结合模式的分析,如图2所示。从图中可以看出,底物的糖基部分结合在活性口袋的亲水性氨基酸部分,主要有Gln20,His132,Glu178和Glu377组成,并与这些氨基酸残基形成了氢键作用,这些作用可以稳定底物的糖基结构,使其在催化过程中维持相对稳定的构象。而底物的硝苯基则在Tyr316,Trp351和Tyr442三个带芳香环侧链的残基附近,可以形成较强的π-π相互作用,另外硝基还与Asn317形成了氢键作用,进一步限制了底物构象的变化。
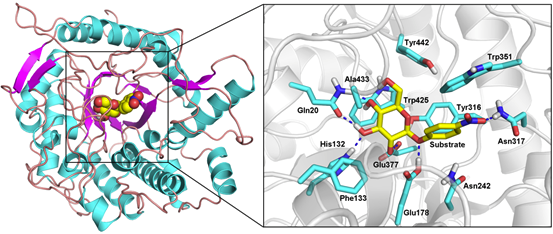
从图3中可以看出,β-葡萄糖苷酶催化水解底物的糖苷键,并生成葡萄糖和对应配基的反应过程如下:底物先结合到β-葡萄糖苷酶的催化活性位点,Glu377的羰基氧原子进攻底物的C原子,使糖苷键断开,配基的氧原子捕获Glu178的氢原子,形成对硝基苯酚结构并脱去;底物的配基脱去之后,水分子进入活性中心,一个氢原子与Glu178的羧基结合,氢氧根负离子结合到葡萄糖上,断开葡萄糖与Glu377的共价键,并生成最终产物葡萄糖。