合作单位: Marine Fisheries Research Institute of Zhejiang
参考文献:Dingyi Yu, Cong Wang, Yufeng Song, et al. International Journal of Molecular Sciences, 2019, 20(17):4159.
DOI: 10.3390/ijms20174159(IF = 4.32)
利用生物信息学方法,从太平洋蟾蜍中预测和筛选了9种氨基酸序列较短的ACE抑制肽。其中,三肽Ile-Ile-Tyr和四肽Asn-Pro-Pro-Lys对ACE表现出较强的抑制作用,本研究表明,太平洋蟾蜍有潜力作为工业生产ACE抑制肽的合适原料,并可以有效地用于治疗高血压。
背景:
血管紧张素转换酶(ACE)是一种参与肾素–血管紧张素系统的金属羧肽酶,不仅控制血压和电解质稳态,还参与肾功能和心肌重构。它可以将激素血管紧张素I转化为血管紧张素II,血管紧张素II是一种有效的血管收缩肽,可使血管变窄,导致血压升高。因此,ACE是降血压和心血管治疗的主要靶点,其抑制作用主要导致整体降压作用。尽管ACE抑制剂与通用ACE活性位点(Zn2+、S1、S1‘和S2‘口袋)有紧密结合模式,并表现出良好的心血管治疗能力,但ACE抑制剂有许多副作用。它们的副作用使研究人员的兴趣集中在寻找替代的无毒和自然产生的肽来控制血压。目前已在多种海洋生物蛋白质资源中发现了ACE抑制肽,由于海洋环境的特殊性,它们的蛋白质组成与陆地生物蛋白质不同。因此,来自海洋生物的蛋白质可以作为挖掘ACE抑制肽的潜在资源。
方案设计:
本研究对9种新肽的体外ACE抑制活性进行了研究,表明太平洋蟾蜍肌球蛋白重链中的Ile-Ile-Tyr和Asn-Pro-Pro-Lys具有降压潜力。经与魔德科技(www.modekeji.cn)技术团队沟通,拟通过分子对接和MD模拟,进一步研究了它们与ACE的相互作用机理和成键构型。
主要结果:
1 分子对接
分子对接可以用来预测这两种肽与ACE结合形成复合物时的首选取向。在实验之前,为了更好地研究ACE与其抑制肽的对接,研究并选择了最大能量评价次数和遗传算法次数等对接参数。最大能量评价数和遗传算法数分别设置为2.5×106和25。利用所选择的参数,将ACE与新的抑制肽进行对接。
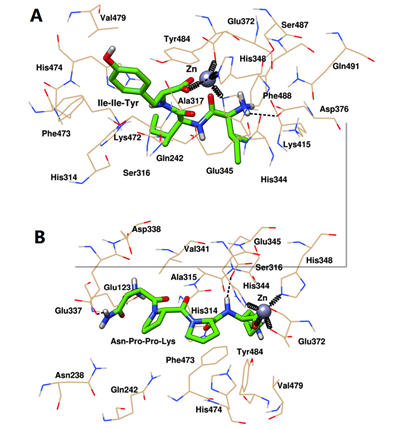
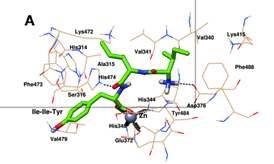
图1的对接构象显示,Ile-Ile-Tyr和Asn-Pro-Pro-Lys可以嵌入ACE的S1疏水口袋中。Asn-Pro-Pro-Lys也接近S1口袋中的Ala315,而Asn-Pro-Pro-Lys不与该残基相互作用。对于S2口袋,Ile-Ile-Tyr在该位点与His314、Lys472和His474紧密结合,而Asn-Pro-Pro-Lys仅位于His314和His474附近。此外,Asn-Pro-Pro-Lys可以与S1’口袋中的Glu123残基相互作用。进一步分析了这两种抑制剂与ACE活性位点周围氨基酸残基之间的相互作用,发现有三种分子力参与了肽的稳定,包括配位、氢键和疏水相互作用。图1显示,Ile-Ile-Tyr和Asn-Pro-Pro-Lys能够与ACE活性位点Zn(II)配合。肽C端氧原子通过配位作用与Glu372、His344和His348接触。如图1A所示,Ile-Ile-Tyr通过与ACE的His348和Asp346残基反应形成两个氢键。该三肽也进入ACE的疏水口袋,并与Gln242、His314、Ser316、Ala317、Glu345、Glu372、Lys415、Lys472、Phe473、His474、Val479、Ser487、Phe488和Gln491残基形成疏水相互作用。如图1B所示,Asn-Pro-Pro-Lys与ACE的对接结果与之前的Ile-Ile-Tyr相似,与Glu337和Glu345残基形成两个氢键。该四肽还与Glu123、Asn238、Gln242、His314、Ala315、Ser316、Asp338、Val341、Phe473、His474、Val479和Tyr484的残基发生疏水相互作用。
2 MD模拟
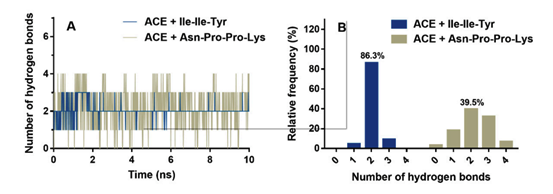
图2A显示了在MD过程中ACE和抑制肽之间的氢键相互作用。在整个模拟过程中,Asn-Pro-Pro-Lys可以与ACE形成3个以上的氢键。而对于Ile-Ile-Tyr,整个MD过程中氢键数很少能超过3个。如图2B所示,两个氢键模型均为ACE与Ile-Ile-Tyr和Asn-Pro-Pro-Lys的稳定构象,频率分别为86.3%和39.5%。此外,为了评估MD过程中的配位,我们计算了Zn(II)与其周围残基之间的距离,包括ACE的His344、His348、Glu372和抑制肽的C端残基(Tyr或Lys)。
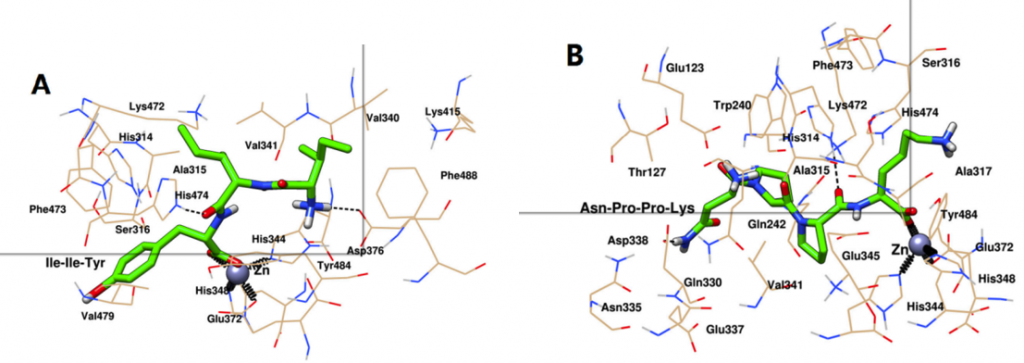
最后,通过选取MD结束后ACE与Ile-Ile-Tyr和Asn-Pro-Pro-Lys的稳定构象,进一步揭示两肽与靶标活性位点的相互作用。如图3A所示,ACE和Ile-Ile-Tyr中的His344、His348和Glu372残基共同与Zn(II)形成配位键。ACE和Ile-Ile-Tyr的His474和Asp376残基之间形成了两个氢键。其他氨基酸残基,如His314、Ala315、Ser316、Val340、Val341、Lys415、Lys472、Phe473、Val479、Tyr484和Phe488残基,在Ile-Ile-Tyr周围形成疏水袋。如图3B所示,同样,Asn-Pro-Pro-Lys、Zn(II)、His344、His348和Glu372残基之间也存在配位作用。在His314和Asp388残基的参与下形成了两个氢键。ACE中的其他残基包括Glu123、Thr127、Trp240、Gln242、Ala315、Ser316、Ala317、Gln330、Asn335、Glu337、Glu345、Val341、Lys472、Phe473、His474和Tyr484,它们可以通过疏水相互作用稳定Asn-Pro-Pro-Lys。
此外,这两种肽在形成稳定的配合物后,被观察到与ACE的S1口袋(Ala315, His344, His348, Glu372和Tyr484)结合。与图1相似,Asn-Pro-Pro-Lys也能与S1口袋中的Glu345相互作用,而Ile-Ile-Tyr则不能。在MD模拟后,他们能够接近S2口袋中的His314、Lys472和His474,这表明它们具有更紧密的键合结构。此外,Asn-Pro-Pro-Lys也可以通过疏水力接近Gln242,这是S2口袋中的另一种残基。对于S1’口袋,Ile-Ile-Tyr距离较远,但Asn-Pro-Pro-Lys与该位点的Glu123残基之间仍存在相互作用。