合作单位:Southwest University
参考文献:Hongxia Tan,Hongyuan Zhou,Ting Guo, et al. Food Chemistry, 2021. DOI:10.1016/j.foodchem.2021.129286 (IF = 9.23)
本研究阐明了玉米赤霉烯酮(ZEN)与玉米蛋白(α-Zein)之间的“隐藏”机制,为建立玉米产品中总ZEN(包括游离ZEN和隐藏ZEN)的检测方法提供了依据。
背景:玉米是全球三大主要经济作物之一,其年产量超过109亿吨,在美国和中国的产量超过4.3亿吨。考虑到玉米在人类消费中的作用,玉米的安全和质量保证问题非常重要。玉米特别容易被产生玉米赤霉烯酮(ZEN)的镰刀菌感染,给农业企业造成巨大损失,并对公众健康造成危害。鉴于ZEN的毒性和高发生率,有必要准确监测ZEN的污染水平,以保障食品安全。然而,如果考虑到所谓的“隐性ZEN”,玉米和玉米产品的污染和安全问题的复杂性就会增加。隐性真菌毒素是通过真菌毒素与基质大成分(如淀粉和蛋白质)的结合相互作用形成的,无法通过常规分析方法检测。然而,在胃肠道条件下,这种络合物可被酶或肠道微生物分解,释放出游离的霉菌毒素,从而对生物体产生危害。据报道,在玉米和玉米制品中经常发现隐性ZEN,其污染水平明显高于游离ZEN。尽管如此,ZEN的隐藏机制(ZEN与玉米蛋白相互作用的性质)仍需要从分子水平和物理化学方面进一步阐明。
方案设计:
为了更好地了解玉米蛋白(α-Zein)通过缔合作用对ZEN的掩蔽作用,经与魔德科技(www.modekeji.cn)技术团队沟通,拟采用从头建模方法构建α-Zein的三维结构,并利用分子对接技术研究ZEN与玉米蛋白的结合机制。主要结果:1. Zein的蛋白结构基于表1给出的α-Zein蛋白氨基酸组成分析,可以发现,α-Zein蛋白中超过一半的氨基酸残基是非极性残基,导致α-Zein蛋白不溶于水。另外,64.73%的氨基酸残基含有螺旋二级结构,与文献一致。α-Zein蛋白结构中存在大量的谷氨酰胺,并且有29个Gln氨基酸位于蛋白的Loop和Turn区域,这些区域暴露在水环境中,这也证明了α-Zein蛋白中存在富含谷氨酰胺的环结构。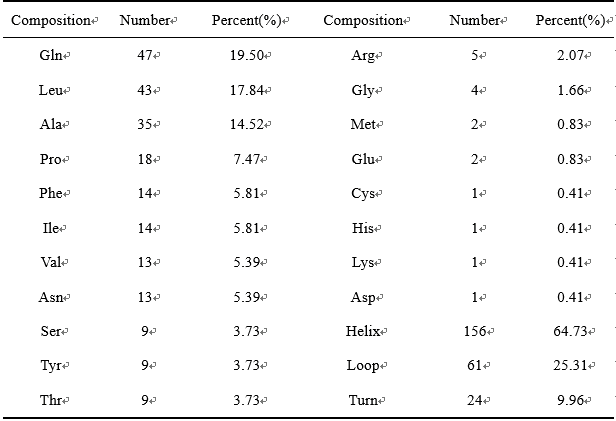
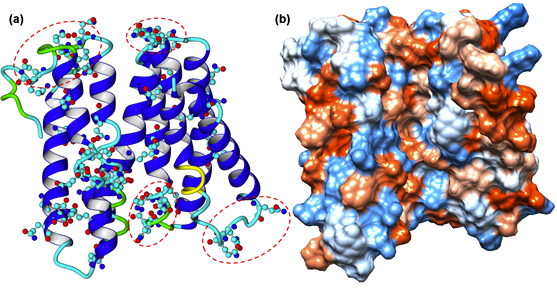
从头模建的α-Zein蛋白结构如图1所示,从图中可以看出,α-Zein蛋白的结构主要由α螺旋组成,其结构中包含了8个螺旋结构,螺旋之间由较短的loop连接,表明α-Zein的结构呈现较大的刚性,而蛋白表面存在一个疏水性空腔,可以结合小分子。α-Zein蛋白的结构尺寸为5.12×4.93×2.83 nm,整体呈扁圆形,体积为29.51 nm3。其回转半径(Radius of Gyration, Rg)为1.86 nm。
- 蛋白结构合理性评估
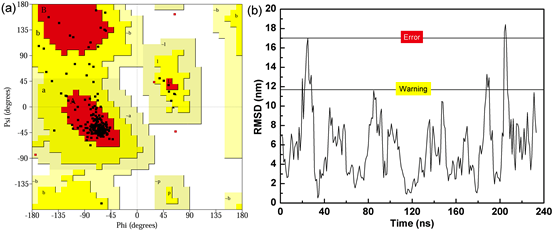
本文采用PROCHECK程序对优化后的蛋白模型进行了评价。PROCHECK程序得到的Ramachandran plot可用于阐述蛋白质或肽立体结构中肽键内α碳原子和羰基碳原子间的键的旋转度对α碳原子和氮原子间的键的旋转度,主要用来指明蛋白质或肽类中氨基酸残基的允许和不允许的构象。Ramachandran plot主要分为三个区域,允许区(红色区域),最大允许区(黄色区域),禁止区(空白区域)。图2a给出了Zein蛋白模型的Ramachandran plot结果,仅有0.92%的氨基酸残基位于扭转角禁止区域,而99.08%氨基酸残基的二面角均在合理范围内,符合立体化学能量规则。
ERRAT是根据晶体学来评价蛋白质三维结构的程序,主要通过统计已报道的蛋白质晶体结构中原子间的非键相互作用得到评价函数,该函数的评价标准与蛋白质的分辨率相关。从图2b中可知,绝大部分氨基酸残基未超过ERRAT的错误限,评分为93.56,符合评价程序的要求。综合Ramachandran plot和ERRAT评分可知,构建得到的α-Zein蛋白结构具有较高的可靠性,可以作为后续研究的模板。
- 分子对接结果
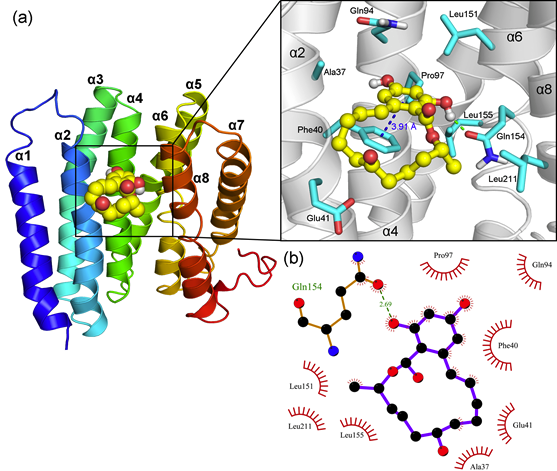
采用分子对接方法将ZEN对接到α-Zein上,得到的结果如图3a所示,从图中可以看出,ZEN在α-Zein蛋白表面主要有4个结合位点,其中亲和力最强的结合位点的结合能为-2.64 kcal/mol,根据能量最低原则,选择结合能最低的构象作为分子对接的最终结果。ZEN与α-Zein的结合如图3b所示,从图中可看出,ZEN主要结合在α-Zein表面的疏水空腔中,与周围氨基酸形成疏水相互作用,分子对接结合能为-2.64 kcal/mol。
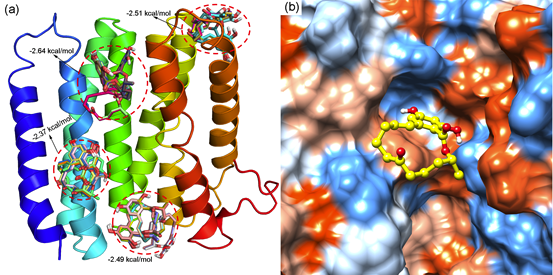
- ZEN与Zein的结合模式
前面的分析表明,ZEN主要结合在蛋白表面的疏水空腔中,疏水作用是二者结合的重要驱动力。为了具体分析哪些氨基酸参与到二者的识别过程,本文对ZEN与α-Zein的结合模式进行了分析,如图4所示。从图中可以看出,ZEN与Gln154的侧链形成了氢键作用,二者距离为2.69 Å,而与Ala37、Phe40、Glu41、Gln94、Pro97、Leu151、Leu155和Leu211形成了较强的疏水作用,另外,ZEN的苯环还与Phe40的侧链苯环形成了π-π堆积作用,二者距离为3.91 Å。