背景
泛素依赖性降解途径( ubiquitin dependent degradation pathway,UDDP) 可降解细胞周期蛋白依赖性激酶抑制因子( cyclin dependent kinase inhibitor,CKI) ,其在癌细胞中的异常表达是癌细胞无限生长的主要原因之一. UDDP 中主要包含3 种酶: 泛素激活酶1( ubiquitin-activating enzyme,E1) 、泛素结合酶2 ( ubiquitin-conjugating enzyme,E2) 和泛素蛋白连接酶3 ( ubiquitin-protein ligase,E3) ,其中E3 与靶蛋白识别的过程是降解途径中的关键限速步骤. 包含F-box 蛋白的SCF( Skp1-Cullin 1-Fbox)型泛素蛋白连接酶E3 是其中重要的一种,受到广泛关注. 作为F-box 蛋白家族的成员之一,S期激酶相关蛋白2( S-phase kinase-associated protein2,Skp2) 与Skp1、Cul1、Rbxl 等因子组成E3 连接酶,参与催化细胞由G1 期到S 期的转变过程.其中Rbx1 通过Cul1 与Skp1 连接,具有激活该蛋白复合体的重要作用,而Skp2 则通过F-box 区域与Skp1 相连. Skp2 蛋白由424 个氨基酸组成,包含Fbox和亮氨酸重复区( leucine-rich repeats,LRR) 2 个重要的功能性区域。 其中,F-box 区域由43 个氨基酸组成,LRR 则主要包含10 个富含亮氨酸的重复序列,并可与底物CKI ( 如p27 等) 特异性识别。 因此,Skp2 蛋白作为一个新颖潜在的Target,受到越来越多研究人员的重视。
最近,Chan 等通过对大量化学数据库进行高通量筛选,发现苯并噻唑类分子( BPC) 对Skp2 E3 具有较高的活性。 体外实验还发现,小分子BPC 在多种动物模型中对细胞都有较好的效果,对应的IC50均小于5 μmol /L,可作为Skp2 开发中的先导分子。 不过,BPC 与Skp2 的结合模式、识别驱动力和结合前后的构象变化等重要的科学问题尚未见报道.
目的
采用同源模建、分子对接、分子动力学( molecular dynamics, MD) 模拟、成簇分析和自由能计算等方法对BPC与Skp2蛋白的分子识别及其作用机理进行探讨,为后续基于Skp2 结构的分子设计提供一定的帮助。
方法
同源模建
分子对接
分子动力学模拟
成簇分析
自由能计算
主要研究结果
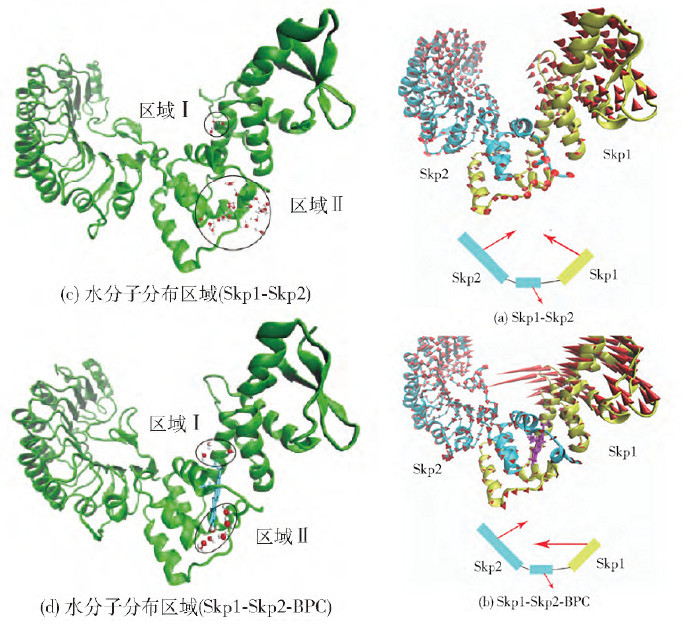
用同源模建、分子对接方法构建Skp1-Skp2 及Skp1-Skp2-BPC 体系,基于2 个体系的50 ns 对比MD 模拟轨迹,研究了BPC 和Skp2 之间的相互作用,并给出了BPC 可能的抗癌抑制机制. 首先对Skp1 缺失的loop 进行补全,并通过PDF、Ramachandran 图和Profile-3D 等参数验证补全模型的可靠性。
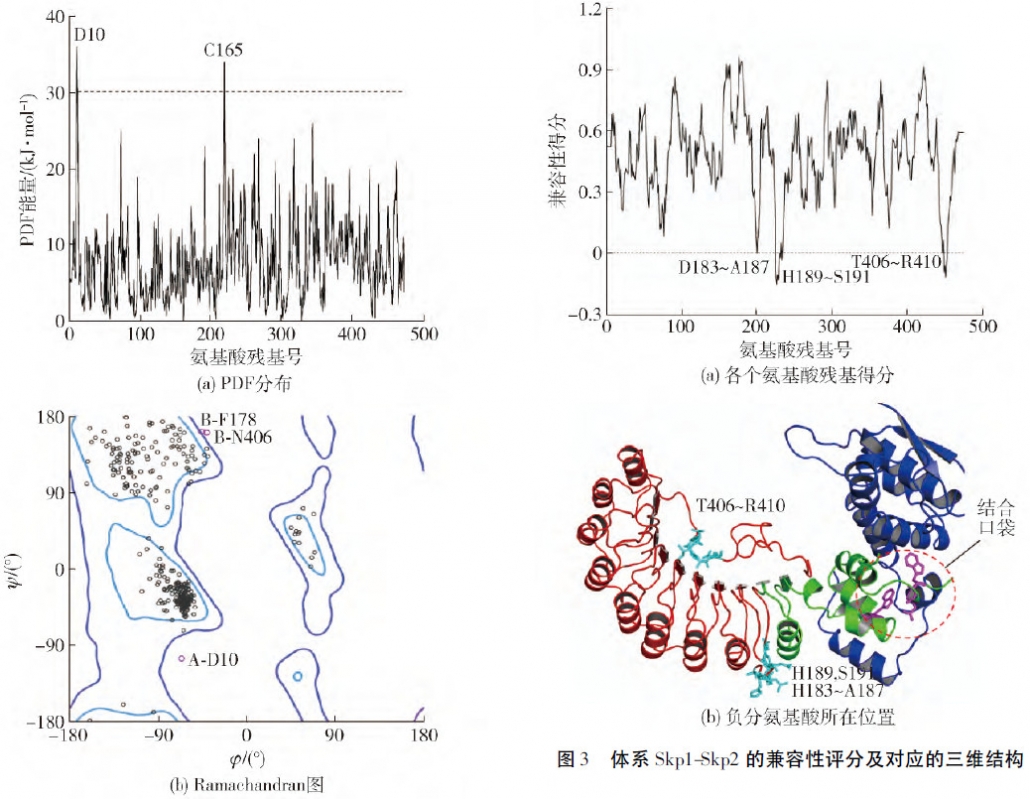
BPC 与Skp1-Skp2 的分子对接结果表明: D110、R138 可以与BPC 中的二氢吡喃酮形成氢键. MD 模拟的RMSF 值与B 因子的显著相关性,证明动力学模拟及其柔性分析的可靠性. 氢键、能量分解及自由能计算结果表明,W109、D110、L117、I120、R138、W139 是Skp2 与BPC 识别的关键残基;疏水相互作用是驱使二者识别的主要驱动力; 自由能计算和关键残基计算结果与实验数据吻合较好.最后通过对比分析体系Skp1-Skp2 和Skp1-Skp2-BPC 的运动模式,BPC 的结合导致了Skp1 运动模式更为剧烈,并有脱离Skp2 的趋势,这可能是该Inhibitor发挥生物学功能的作用之一.