合作单位:ShandongFirst Medical University & Shandong Academy of Medical Sciences
魔德科技:采用分子模拟方法研究YdiU蛋白与UTP/ATP的分子识别
参考文献:Cell Report. 2020, 32(12), 108161. DOI: 10.1016/j.celrep.2020.108161(IF = 12.60)
- 背景
沙门氏菌对周围环境的变化具有比较明显的感受,为了适应这种变化,细菌会调整胞内的生命活动。蛋白的翻译后修饰(PTMs)是一种可以迅速传导胞内信号的方式,参与了细菌体内多种生命活动过程,其中磷酸化和乙酰化是常见的PTMs类型。随着实验技术的不断发展,有一些其他的PTMs类型被鉴定出来,但是对于新型的PTMs类型,其在细菌生命活动中的产生方式和功能尚不清楚。
本研究报道了一种YdiU蛋白催化的新型PTMs类型——单磷酸尿苷酸化修饰(UMPylation)。通过解析晶体结构发现UMPylation主要发生在蛋白的酪氨酸和组氨酸上。另外研究表明,当体内的ATP不足时,YdiU蛋白可以利用另一种核苷酸UTP来实现对蛋白的UMPylation修饰,并且在Mn2+离子存在下,可以显著提高YdiU蛋白与UTP的亲和力,而对于ATP却没有明显的作用。由于目前实验条件的限制,可以获得YdiU-ATP的晶体结构(PDB ID: 6LNA),但很难获得YdiU-UTP的晶体结构。
- 方案设计
鉴于目前实验条件很难获得YdiU-UTP的晶体结构,为了深入研究YdiU利用UTP进行UMPylation修饰的作用机制,经与四川魔德科技(www.modekeji.cn)技术团队深入沟通,拟基于YdiU-ATP的晶体结构,采用分子模拟方法获得YdiU与UTP的复合物结构,并研究Mn离子对ATP和UTP与YdiU蛋白亲和力的影响。
- 主要结果
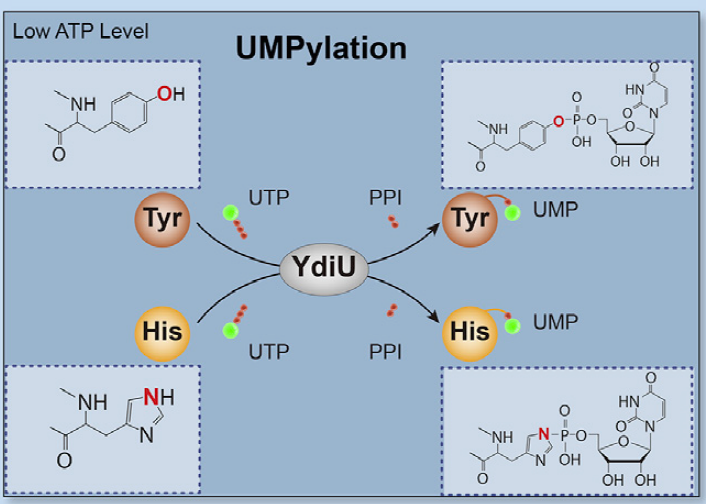
1、偶然发现: UMP而非AMP
YdiU蛋白家族是广泛存在与细菌中的保守蛋白家族,被预测为无活性的“假激酶”,是最具研究价值的未知功能蛋白家族之一。在本文之前,一直认为该类蛋白家族可能具有催化蛋白单磷酸腺苷酸化(AMPylation)修饰的活性。但本文在研究YdiU蛋白的功能时,发现只有在压力应激条件下,沙门氏菌才启动YdiU蛋白的表达,深入分析之后,发现YdiU蛋白表达之后,沙门氏菌体内46个蛋白中均发现了一种新型的蛋白结构修饰——UMPylation,却并没有发现AMPylation修饰的蛋白。
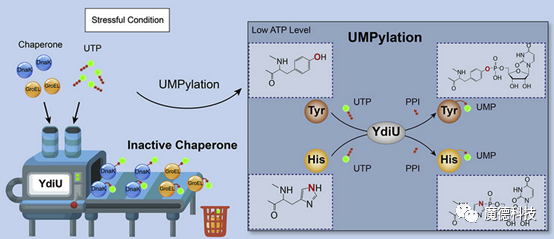
图1 YdiU蛋白在ATP缺乏时进行UMP修饰的示意图
2、YdiU-UTP催化UMPylation修饰的机制研究
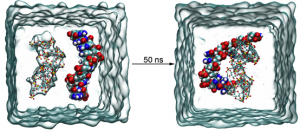
进一步研究发现,UMPylation修饰主要发生在蛋白的酪氨酸和组氨酸上,周围还存在大量的疏水氨基酸和负电荷氨基酸。另外还发现Mn2+离子在UMPylation修饰过程中具有非常重要的作用。亲和力数据表明Mn2+可以显著提高YdiU与UTP的亲和力,而对ATP的亲和力却没有显著作用。但实验手段难以解析获得YdiU-UTP-Mn2+的晶体结构。因此本研究采用分子动力学模拟方法构建并优化了YdiU-UTP-Mn2+的模型。
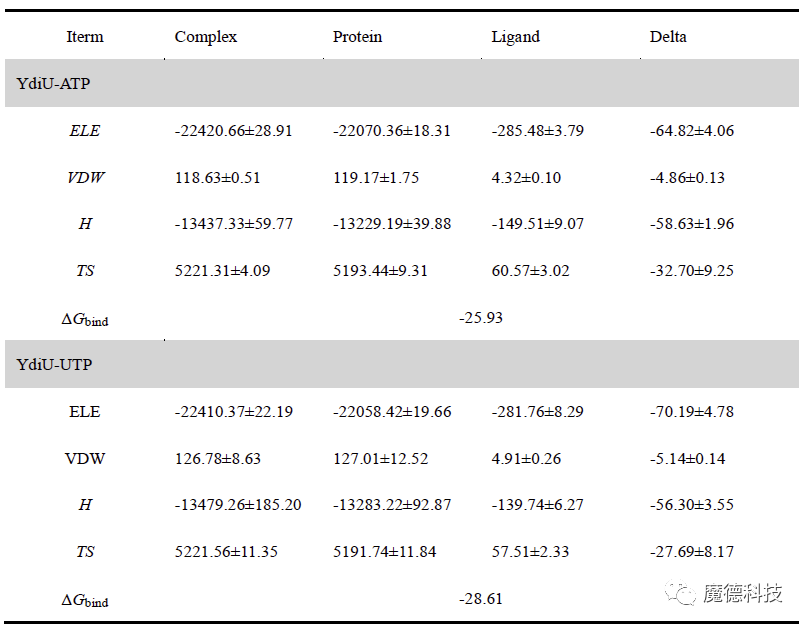
分子动力学模拟结果表明,UTP与YdiU的结合明显更强,主要体现在Mn2+离子与周围氨基酸残基的配位作用。如下图所示,在YdiU-ATP-Mn2+体系中,Mn1离子只与周围3个氧原子配位,Mn2与周围4个氧原子配位,而在YdiU-UTP-Mn2+体系中,2个Mn离子均与周围的氧原子形成了5个配位。另外,通过对比ATP和UTP与YdiU-Mn2+的结合模式,可以发现D246在与Mn的配位出现了比较明显的变化,在UTP体系中,D246更容易与Mn2+离子配位。通过计算结合自由能也可以发现,ATP和UTP与YdiU的结合自由能分别为-25.93kcal/mol和-28.61 kcal/mol。
综上所述,通过分子模拟研究,可以发现,ATP和UTP与YdiU-Mn2+的结合模式有一定程度的差异,主要体现在Mn离子的配位和D246的构象变化,这可能是YdiU蛋白与UTP亲和力更强的主要原因之一。
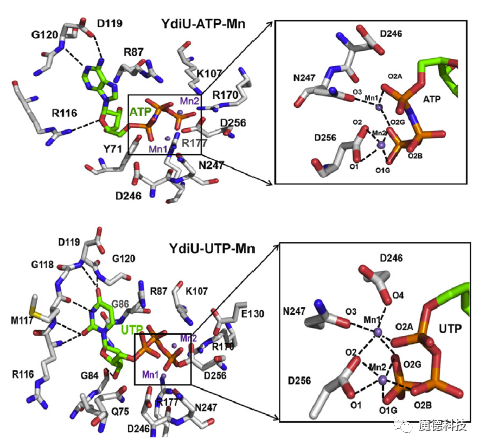
图2ATP/UTP与YdiU-Mn2+的结合模式图
表1ATP和UTP与YdiU蛋白的结合自由能的贡献
3、UMPylation修饰调控分子伴侣功能
为了进一步研究UMPylation修饰调控分子伴侣的机制,本研究分析了UMPylation修饰的具体氨基酸位点,发现UMPylation修饰位点均发生在分子伴侣与底物或辅因子结合的界面上。
研究表明,YdiU的UMPylation修饰可以明显抑制DnaK和GrpE的结合,同时还阻碍了GroEL与底物的结合。研究证明,UMPylation修饰作为一种负调控机制可以关闭分子伴侣的功能。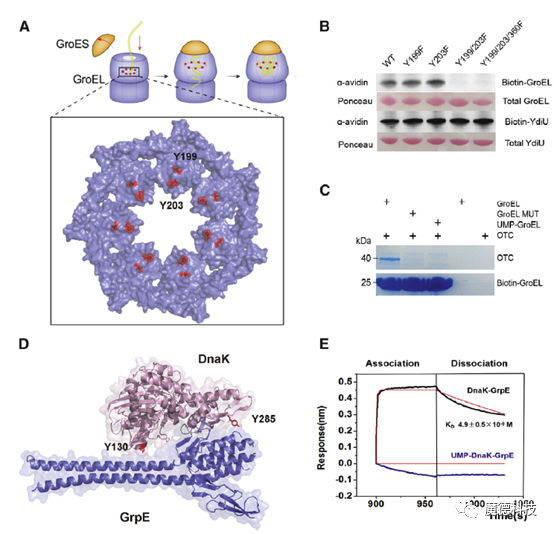
图3 UMPylation修饰可以阻止伴侣蛋白与底物或辅因子的结合
- 看点
当细菌遭受压力环境时,分子伴侣的功能主要是帮助损伤的蛋白进行快速修复,这个过程会消耗大量的ATP。本研究发现,在压力环境下,细胞内的ATP严重不足,这时YdiU蛋白可以在UTP的作用下,发挥UMPylation修饰的功能,对分子伴侣蛋白进行修饰,关闭其修复功能。进而保护细菌在压力环境下,不会因为ATP大量消耗而衰竭致死。