合作单位:Marine Fishery Research Institute of Zhejiang Province
参考文献:L Jin, XJ Zhang, H Shi, W Wang, ZH Qiao, WG Yang, and WY Du. J. Agric. Food Chem., 2020, 68(8): 2516-2527. DOI: 10.1021/acs.jafc.9b07833 (IF = 3.80 一区top期刊)
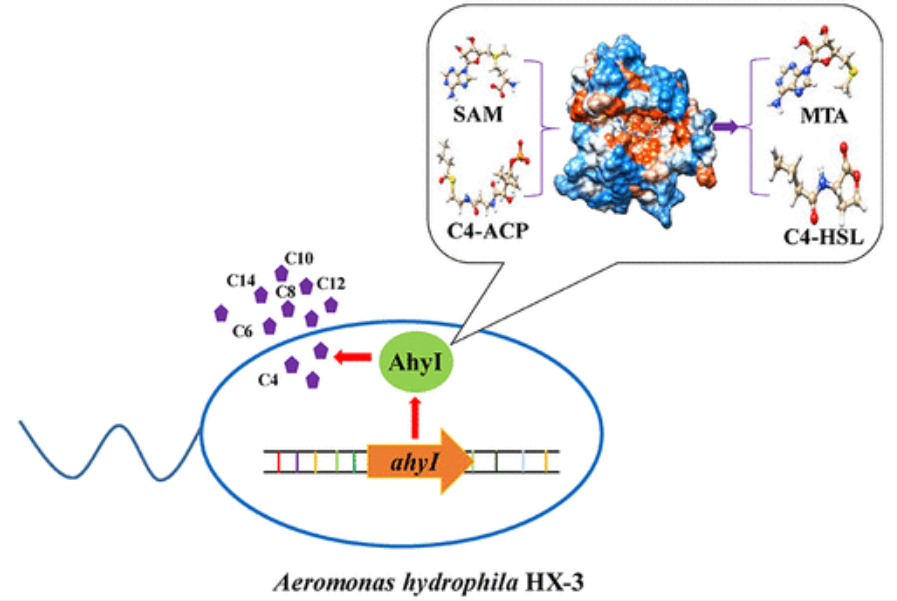
在革兰氏阴性细菌嗜水气单胞菌中,N-酰基高丝氨酸内酯(AHL)介导的群体感应(QS)影响致病性,蛋白质分泌和运动性。本文从分离的嗜水气单胞菌HX-3中克隆了AhyI基因,并首次证实该蛋白可以催化产生六种类型的AHL,而不是常规认为的两种。
背景:
嗜水气单胞菌(A. hydrophila)是一种革兰氏阴性菌,被称为人和动物的机会致病菌。A. hydrophila在水产养殖环境中无处不在,并导致鱼类,虾和蟹的疾病。食用受污染的水生动物后,人类可能会感染并发展为败血症,肠胃炎,骨髓炎和腹膜炎等。因此,近年来亲水型链球菌对食品安全的重要性已经成为人们广泛关注的问题。迄今为止,三种典型的亲水性在嗜水气单胞菌中已经发现了自动诱导物(AI)系统,包括基于AHL的自动诱导物AI-1系统,依赖S-核糖基同型半胱氨酸酶(LuxS)的自动诱导物AI-2系统,以及基于QseB / QseC的自动诱导物AI -3系统。
AHL合酶LuxI催化的AHL生物合成机制已证明涉及酰基从酰化酰基载体蛋白(酰基-ACP)到S-腺苷-L-甲硫氨酸(SAM)氨基的转移。涉及酰基-SAM中间体的酰基转移反应被认为是在羧化氧的内酯化形成AHL产物和S-甲基硫代腺苷(MTA)之前发生的。最近,LuxI的同系物,BjaI仅使用酰基辅酶A和SAM作为底物,通过特定的酰基SAM中间体进行内酯化形成AHL。有趣的是,BjaI的研究证明了乙酰辅酶A可以作为BjaI催化脂肪链底物产生AHL的因子,而不是酰基-ACP。AHL合成的独特机制表明,底物与其他LuxI合成酶的作用截然不同。 迄今为止,尚未报道在AHL合酶反应过程中具有结合的底物的AhyI的详细结构,尽管已鉴定出完整的氨基酸序列和AhyI的保守残基,但各个氨基酸残基的作用仍不清楚。本研究中,将嗜水链球菌HX-3的AhyI基因克隆到大肠杆菌中,并通过系统发育分析和多序列比对鉴定评估AhyI酶。同时采用分子模拟方法研究了AhyI-C4ACP-SAM和AhyI-C12/14ACP复合物的分子结构,并对该酶的催化机制进行了探讨。
方案设计:
作者先从嗜水链球菌HX-3中分理处AhyI基因,并克隆到大肠杆菌中,通过UPLC-MS / MS方法分析鉴定出由AhyI催化产生的6种AHL。但AhyI与不同底物的结合模式,以及催化产生不同AHL的作用机制尚不清楚,因此魔德科技采用分子模拟方法对AhyI与底物之间的分子识别机制展开了深入研究。
主要结果:
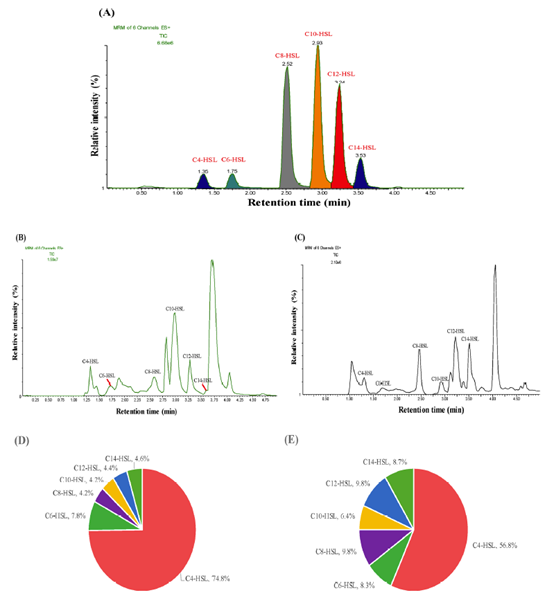
本文采用UPLC-MS / MS方法从链球菌和大肠杆菌中分离鉴定出6种不同的AHL产物,如图所示。
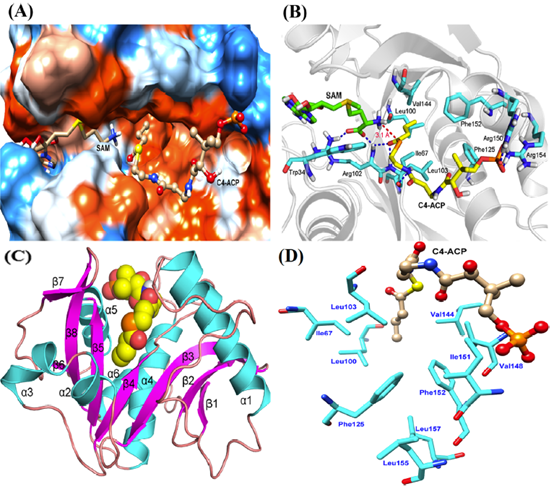
由于目前AhyI的晶体结构尚未解析出来,因此本文首先采用同源模建方法构建了AhyI蛋白的空间结构,然后采用Autodock 4.2.6程序将底物对接到AhyI蛋白的活性位点中,筛选得到合理的复合物结合构象。
结果表明,底物C4-ACP的脂肪链主要结合在AhyI蛋白中较深的疏水性口袋中(由疏水性氨基酸Ile67,Leu100,Leu103,Val144和Phe152组成),这些疏水性氨基酸提供的强疏水环境可以极大的增强底物脂肪链与蛋白的亲和力,并可以稳定底物构象,使其与SAM具有较好的催化距离。
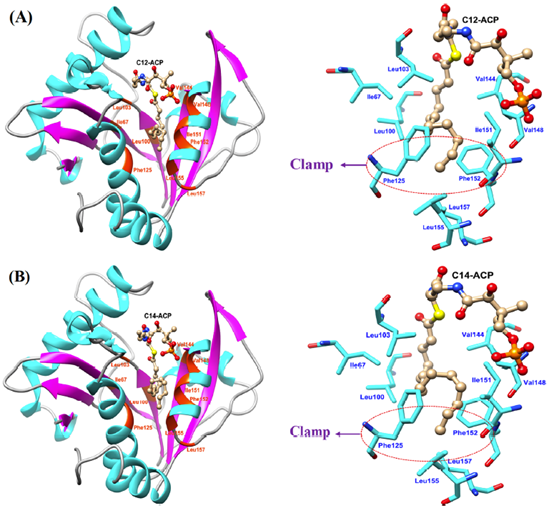
最近,Shin等人发现具有较短脂肪链的底物可能会结合在同源蛋白RhlI的激活口袋附近,而长链的底物分子可能结合在附近的抑制口袋中,因为抑制口袋具有更大的空间,并且具有较多的疏水性氨基酸残基。为了进一步研究AhyI能够催化长链底物的主要原因,本文将C12-ACP和C14-ACP分别与AhyI蛋白对接,结果如下图所示。值得注意的是,两个长链底物的非极性脂肪链占据了相同的口袋,该口袋与RhlI的抑制口袋位置一致。口袋的内部主要有大量的疏水性氨基酸组成。并且,AhyI与长链底物的结合模式中,Phe125和Phe152形成了一个“夹子”,可以固定住C12-ACP和C14-ACP尾部的甲基基团,这与同源蛋白RhlI中的Leu124-Val35和AiiA lactonase中的Phe64-Phe68非常相似。
尽管本研究中提供的蛋白-底物复合物模型不足以更加深入理解AhyI的催化机理,但是可以合理地假设这些酶具有相似的机理,因为这些LuxI同源蛋白之间存在结构相似性。 尽管关于AhyI的这一假设仍有待证明,但我们对AhyI的结构功能将在未来展开更加深入的研究,并提供其催化机制的相关信息。