合作单位:Zhejiang Ocean University
参考文献:Yuping Tang, Yafeng Zhou, Qiaojun Zhao, et al.. Process Biochemistry, 2020. DOI: 10.1016/j.procbio.2020.02.015 (IF = 3.06)
本文首次报道采用生物酶法通过MOT来制备奥利司他中间体(R)-MHOT,该研究成果为奥利司他的绿色合成奠定了基础。
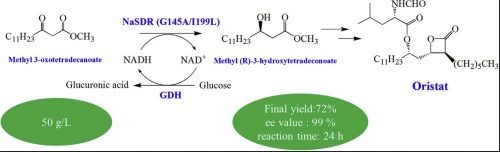
背景:
奥利司他(Orlistat)是一种有效的,特异性的,长效胃肠道脂肪酶抑制剂,可以通过抑制脂肪酶来减少饮食中脂肪的吸收,进而减轻体重。目前,奥利司他的获得途径主要分两种:以天然产物利普斯他汀(Lipstatin)为起始物进行结构修饰得到;或者采用天然产物全合成方法。然而,利普斯他汀难以提取,导致患者难以负担昂贵的医药费用。而全合成方法可以减少花费,是目前制备奥利司他的主要方法。
(R)-MHOT是合成奥利司他过程中非常关键的中间体,目前获得(R)-MHOT的方法主要有化学合成和生物合成两种。化学方法由于ee值低,花费高等缺点难以大规模生产,因此生物合成方法是目前最具前景的合成方法。
近年来,还原酶在手性化合物的合成中发挥着重要的作用,大量的手性化合物都可以采用还原酶来合成。然而目前还没有还原酶不对称还原MOT产生(R)-MHOT的相关报道。本文根据之前研究的成果,采用NaSDR-G145A/I199L酶催化还原MOT产生(R)-MHOT,产量达到50 g/L。并采用分子模拟方法对该酶与MOT的结合模式及突变体产率增加的机制进行了深入研究。
方案设计:
作者先构建得到NaSDR及G145A/I199L突变体重组蛋白,并在不同温度,pH等条件下测试酶对MOT的催化效率。最后采用分子模拟方法,研究了酶及突变体与MOT的最适催化构象,并解释了突变体产率增加的原因。
主要结果:
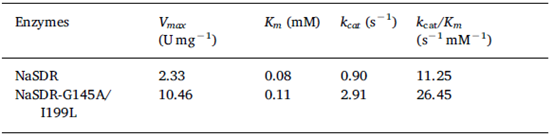
在非线性回归的分析基础上,NaSDR和NaSDR-G145A/I199L催化MOT的Km值分别为0.08和0.11 mM,而野生型和突变体的kcat值分别为0.90/s和2.91/s,突变之后该酶的催化效率提高了3倍以上。
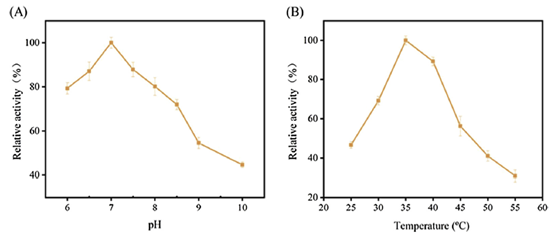
通过测试不同pH和不同实验温度对酶活性的影响,发现在pH=7和35℃附近,该酶具有较好的催化能力,如下图所示。
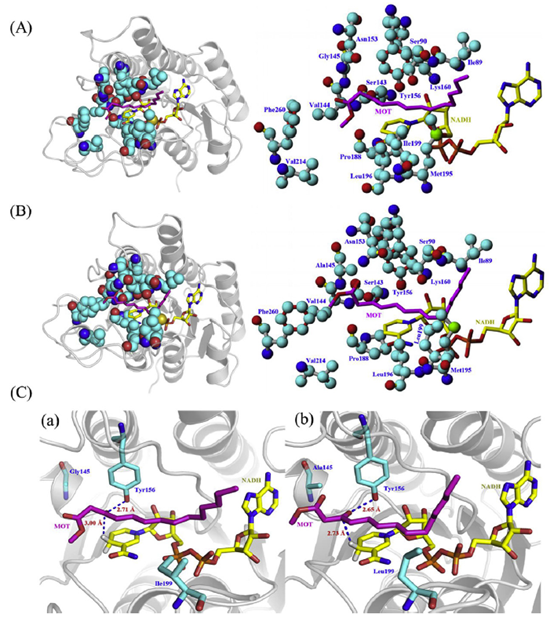
最后,本文采用分子对接方法研究了NaSDR和NaSDR-G145A/I199L催化MOT的最佳构象进行了研究。首先采用同源模建方法得到蛋白的三维结构并进行合理性评估。再将MOT分别对接到NaSDR和NaSDR-G145A/I199L的催化活性位点,结果如图2所示。从图中可以看出,MOT主要可以结合在蛋白的疏水空腔中,与辅酶NADH具有较近的距离,适合催化反应的发生。
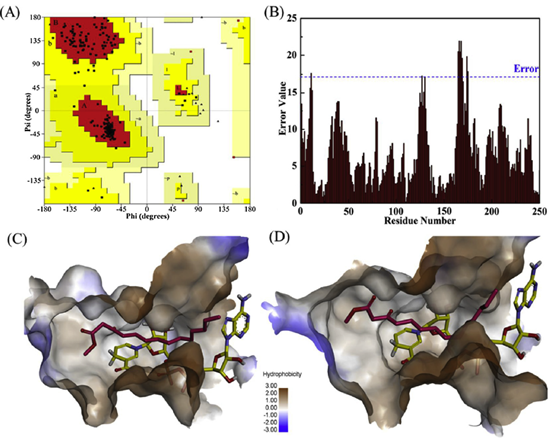
为了进一步研究突变前后MOT与蛋白的结合差异以及引起催化效率变化的主要原因,图3分析了MOT与周围氨基酸残基的相互作用情况。从图中可以看出,MOT主要结合在由Ile89, Val144, Met195, Leu196, Val214, Phe260 和NADH组成的疏水性口袋中。Ser143和Tyr156可以作为氢键供体与MOT形成氢键相互作用。而突变体中,Gly145突变为Ala145,Ile199突变为Leu199,可以进一步增强活性位点的疏水性质,进而增强MOT与突变体的结合能(由-5.02增加到-5.61 kcal/mol)。并且在突变之后,MOT中的羰基碳原子与NADH的催化距离由3.00 Å减小到2.73 Å,进一步证明了突变之后更有利于MOT的催化反应。
总的来讲,本文通过实验证明了NaSDR-G145A/I199L在35℃、中性条件下催化MOT产生(R)-MHOT的产量达到了50g/L,并通过分子模拟方法从原子层面解释了突变体产量提升的可能原因。定点突变或定向进化技术可以进一步提高该酶的催化能力,并用于大规模制备中间体(R)-MHOT。



