合作单位:Heilongjiang Bayi Agricultural University
参考文献:Lingyan Dai, Lingxin Kong, Xiao Cai, et al. Journal of agricultural and food chemistry, 2022. DOI:10.1021/acs.jafc.1c04484(IF = 6.1)
背景:
2型糖尿病(T2D)是一种由胰岛素抵抗和胰腺中β细胞激素胰岛素相对缺乏引起的高血糖疾病。肠促胰岛素,如胰高血糖素样肽1 (GLP-1)和葡萄糖依赖性促胰岛素多肽(GIP),通过促进葡萄糖刺激β细胞分泌胰岛素而抑制胰高血糖素的分泌,从而有效降低血糖水平。然而,这些肠促胰岛素很快被二肽酶IV (DPP-IV)灭活,降低了它们对高血糖的作用。因此对DPP-IV的抑制作用被认为是治疗T2D的重要手段。
与人工合成的DPP-IV抑制剂相比,天然食物来源的DPP-IV抑制分子毒性更小,副作用更少。高粱是世界第五大粮食作物,蛋白质含量丰富。高粱醇溶蛋白在高粱总蛋白中所占比例最高,是白酒酿造和工业乙醇生产的主要副产物。然而,高粱醇溶蛋白的利用率极低,造成了植物蛋白资源的大量浪费。一项研究评估了BIPEP-UWM数据库,发现高粱醇溶蛋白是DPP-IV抑制肽的良好前体。然而,本研究仅通过数据库提供了初步预测,还需进一步深入研究。
方案设计:
实验从高粱醇溶蛋白的木瓜蛋白酶水解物中鉴定出28个含有5 ~ 10个残基的肽段。
经与魔德科技(www.modekeji.cn)技术团队沟通,拟通过分子对接方法对这些肽进行筛选,并分析其抑制DPP-IV的机制。
主要结果:
根据Peptide Ranker工具,16个肽的得分大于0.5(表1),表明这些寡肽具有高概率的生物DPP-IV抑制活性。将16个寡肽结合到DPP-IV的部分活性中心(表1),其中15个寡肽的肽评分大于0.5,只有LAMAVAQVA的peptide Ranker评分小于0.5。在相关综述中,43个DPP-IV抑制肽被证明大多是含有3 – 10个氨基酸的短肽。超过10个氨基酸残基的肽长度可能不会抑制DPP-IV。
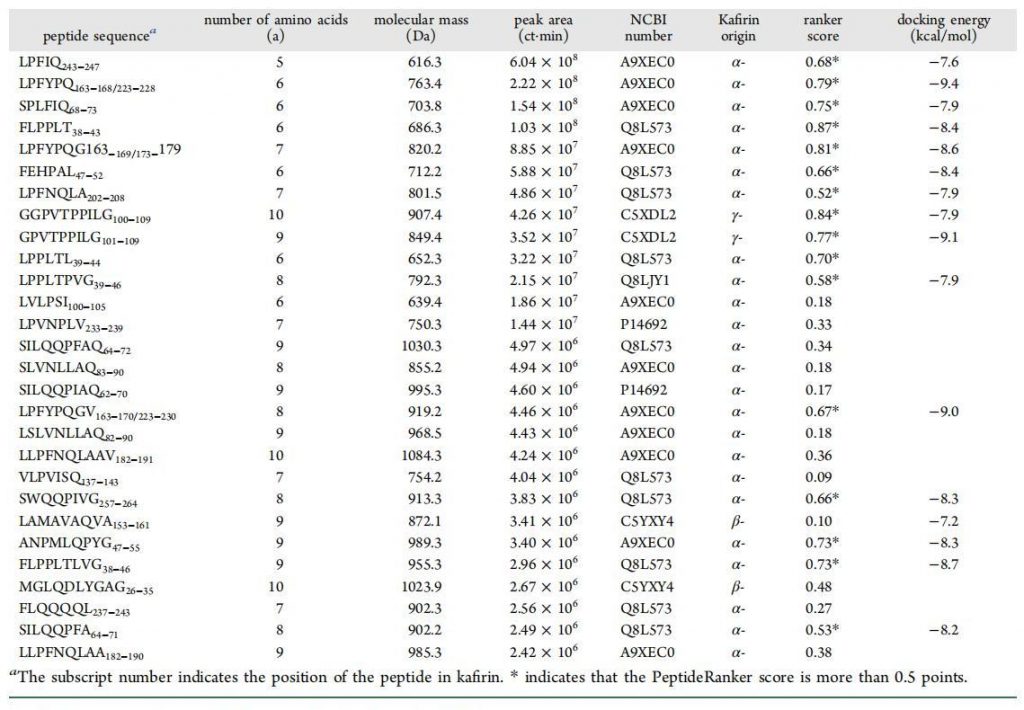
表1
分子对接所需的结合能依次为LP6(−9.4 kcal/mol)和LP8(−9.0 kcal/mol)。其次是GP9(−9.1 kcal/mol)。这三种寡肽较低的结合能表明它们对DPP-IV具有潜在的抑制作用。同时,它们也呈现出典型的Xaa-Pro残基结构,显示出与牛奶蛋白相似的结构特征和DPPIV抑制活性。
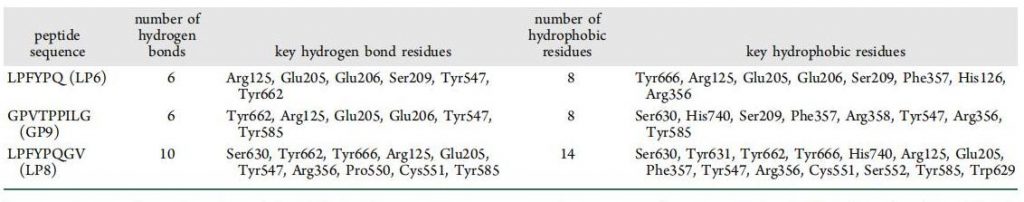
表2
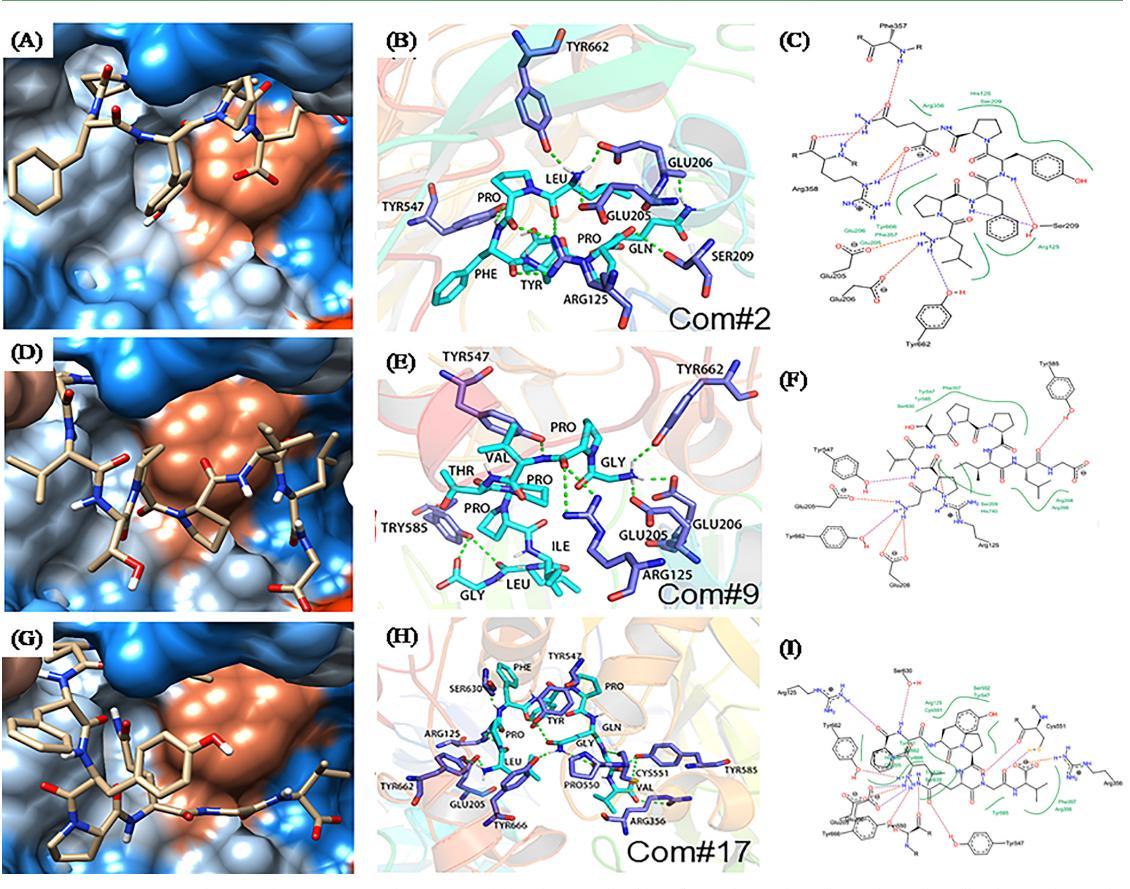
高粱醇溶蛋白DPP-IV抑制肽的作用机制。有研究表明,抑制剂与DPP-IV酶的结合位点主要是S1和S2两个口袋的结合。S1口袋主要由Tyr666、Ser630、Trp659、Tyr631、Val656、Tyr662、Asn710、Val711、His740组成;S2口袋主要由Phe357、Ser209、Glu205、Arg358、Glu206和Arg125组成。同时,Val207、Lys544、Tyr547、Trp627、Trp629、Asp708等残基也参与抑制肽与DPPIV的结合。在本研究中,LP6、LP8和GP9与DPP-IV相互作用,结合能均低于−9.0 kcal/mol。3种与DPP-IV酶结合的抑制寡肽的关键残基如表2所示。氢键和疏水相互作用是介导DPP-IV酶识别抑制肽的关键驱动力。其中S1口袋中的Tyr547、Tyr662和S2口袋中的Arg125、Glu205、Glu206是增强寡肽与DPP-IV通过氢键结合的关键残基。此外,除了活性位点S1和S2口袋中的残基外,Tyr547是唯一与所有三个寡肽形成氢键的氨基酸残基。Tyr547、Arg356、Tyr585以及S1口袋中Ser630、Tyr666和His740和S2口袋中Arg125、Glu205、Ser209和Phe357是通过疏水相互作用促进寡肽与DPP-IV结合的关键氨基酸(表2)。
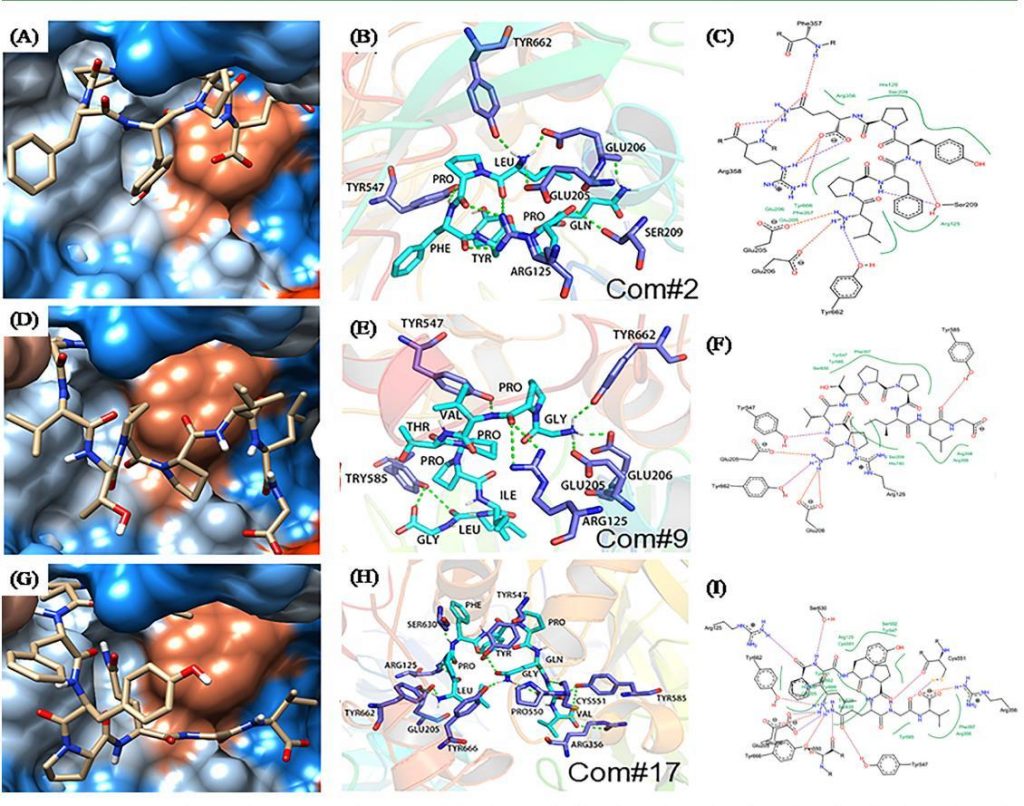
图1
通过分析LP6、LP8和GP9与DPP-IV蛋白的结合方式,我们发现它们在DPP-IV蛋白亲疏水表面的分布有一个共同的特点,即寡肽主要结合在DPP-IV蛋白上的亲水空腔上。这些寡肽与周围的氨基酸形成了更多的亲水性相互作用,并且更大的疏水区域位于与寡肽形成疏水相互作用的口袋内,进一步增强了相互作用(图1)。这些结果证明,LP6、LP8和GP9以合理的构象结合到DPP-IV蛋白腔内由S1和S2两个口袋组成的活性中心,抑制了DPP-IV的生物活性。这些结果为植物来源的DPP-IV抑制肽提供了额外的证据。
结论:
综上,本研究成功从高粱醇溶蛋白中纯化出具有DPP-IV抑制活性的LP6、GP9和LP8。分子对接发现,三种抑制寡肽通过低相互作用能结合DPP-IV的活性位点,有效灭活了DPP-IV。对这三个抑制寡肽的计算分析表明,它们都通过氢键和疏水相互作用结合到DPP-IV的S1和S2活性口袋上。这些结果为研究具有潜在DPP-IV抑制活性的植物蛋白提供了新的视角。