合作单位:Dalian Medical University
参考文献:Xuemei Hu, Nan Shen, Anqi Liu, et al. Molecular therapy: the journal of the American Society of Gene Therapy. DOI:10.1016/j.ymthe.2021.10.012(IF = 12.91)
背景:
肾间质纤维化(RIF)是慢性肾脏疾病中的一种。肾间质肌成纤维细胞的增加被认为是RIF的罪魁祸首。肾间质肌成纤维细胞是多细胞起源的。周细胞向肌成纤维细胞转化是RIF中肌成纤维细胞的主要来源。此外,成纤维细胞和巨噬细胞向肌成纤维细胞的转化也参与了RIF。因此,抑制周细胞、成纤维细胞和巨噬细胞的激活可以开发一种潜在的有效治疗RIF的方法。然而,RIF是一个涉及多个细胞的复杂过程,单细胞或单信号通路抑制的效果可能效果不佳。多种交联纤维化信号通路的过度激活是细胞激活的基础。然而,如何抑制这些通路的过度激活尚未被探索。由于蛋白质的翻译后修饰对其功能至关重要,因此针对这些通路蛋白的共同修饰位点而不是单独干扰蛋白质分子更为合理。研究发现由α1,6-岩藻糖转移酶FUT8特异性催化的核心岩藻糖基化(CF)是多种纤维化蛋白翻译后修饰的关键,FUT8敲除小鼠的RIF减少。
涉及间充质干细胞(MSCs)的细胞疗法已成为肾脏疾病的选择。尽管MSCs对RIF有有益的作用,但其临床应用面临许多挑战。因此,我们使用MSC衍生的外泌体代替MSCs作为CF的候选调节因子。
方案设计:
研究发现,外泌体通过受体介导的结合将miRNA传递到特定的受体细胞类型,从而介导不同细胞类型之间的串扰。经与魔德科技(www.modekeji.cn)技术团队沟通,拟采用分子模拟方法对介导miR-34c-5p从外泌体到周细胞的传递展开研究。
主要结果:
CD81-EGFR复合物的形成帮助miR-34c-5p进入周细胞下调CF
通过蛋白质组学分析筛选出1708个周细胞蛋白和1687个外泌体蛋白。利用STRING软件检测蛋白相互作用,鉴定出84种周细胞外泌体相互作用膜蛋白。绘制了蛋白质-蛋白质相互作用网络,为可视化受体介导的结合提供了一个框架。在网络中,节点越大,蛋白质相互作用越多,说明该蛋白质在网络中更重要。EGFR蛋白的节点最大。在最接近EGFR的蛋白中,CD81的节点最大。外泌体和周细胞蛋白质组学筛选出膜配体和靶受体CD81-EGFR。
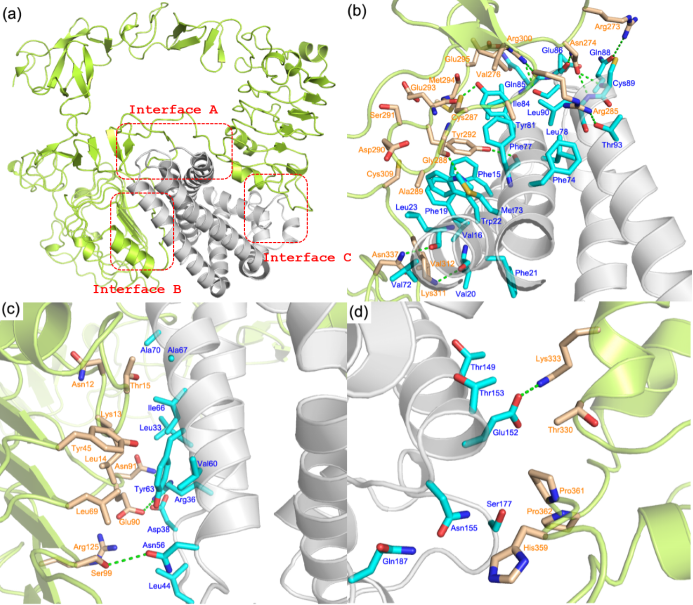
假设EGFR-CD81复合物可能在介导miR-34c-5p从外泌体到周细胞的传递中发挥重要作用。然后,基于分子模拟技术构建了全尺寸EGFR和CD81的空间三维结构。使用分子对接方法估计EGFR和CD81细胞外结构域之间的相互作用,确定了EGFR与CD81结合的三个位点。CD81细胞外区与EGFR配体结合区结合形成复合物(图1), FUT8不与EGFR配体结合区结合,不影响CD81-EGFR复合物的形成。旨在验证CD81-EGFR复合物形成的免疫荧光染色显示,外泌体处理后EGFR荧光降低。从蛋白质的结构和功能及其相互作用结果来看,可能的原因是CD81主要通过氢键和疏水作用与EGFR配体结合区结合,从而影响氨基酸残基的构象,降低EGFR荧光强度。3D荧光显示外源性CD81与EGFR结合,为EGFR和CD81之间的结合提供了证据。
本文揭示了间充质干细胞(MSC)衍生的外泌体在位于膜上的CD81-表皮生长因子受体(EGFR)复合物的帮助下,特异地存在于损伤的肾脏中,通过融合到周细胞、成纤维细胞和巨噬细胞中,随后将微RNA (miR)-34c-5p传递到细胞中,抑制几种重要的促纤维化蛋白的CF,从而改善多细胞活化和肾脏纤维化。研究结果揭示了MSC来源的外泌体在通过CF抑制多细胞激活中的新作用,并为肾纤维化提供了潜在的干预策略。


