合作单位:Shandong University
参考文献:Leiqiang Han, Shuang Liang, Weiwei Mu, et al. Asian Journal of Pharmaceutical Sciences, 2022, 17( 1):129-138. https://doi.org/10.1016/j.ajps.2021.11.002(IF = 9.289)
利用SMA将疏水药物转化为纳米组装体的这一发现显示了巨大的药物递送潜力,这鼓励我们进一步验证药物偶联策略并探索更多有用的SMA。
背景
纳米医学已被广泛用于递送疏水药物,其优点有溶解度增加,暴露时间延长,可以选择性递送到肿瘤以及治疗指数提高等优点。然而,纳米制剂的开发通常需要复杂的方案,包括新材料的合成、纯化和超分子自组装,这带来了各种各样的挑战。因此找到一个更有效的策略是非常有必要的。
无载体纳米药物是近年来发展起来的一种新型药物。与传统纳米药物相比,无载体纳米药物具有以下优点:(1)自组装成稳定的纳米颗粒;(2)载药量大;(3)避免准备额外载体的繁琐步骤;(4)无载体毒性和免疫原性。根据组装机制的不同,无载体纳米药物可分为前药自释和纯药自释。前药自释通常是通过合适的化学连接剂将活性药物与其他分子偶联,形成稳定的纳米化合物来实现药物自我递送。纯药自释完全由具有药理活性的分子组成,可以由一种药物单独构建,也可以由多种药物构建。但无载体纳米药物没有考虑药物的比例和药物联合的合理性。
本文通过在分子水平上研究化合物的共组装行为,建立了一种新的药物偶联策略。对于药偶组合,“药”代表难溶于水的疏水药物。“偶”代表一种两亲性小分子,它同时具有亲水和亲脂性质。这种小的两亲性分子被称为small molecular mate(SMA),它可以介导多肽在细胞内组装成正确的蛋白质。
本文通过MD模拟和量子化学计算研究了共组装机制和构效关系,以证明假设,即SMA可以将疏水药物转化为纳米组装体。这一假设在十多种SMA中进行了探讨,并用五种化疗药物进行了测试:索拉非尼(SF)、10-羟基喜树碱(HCPT)、多西他赛(DTX)、伊鲁替尼(IBR)和拉帕替尼(LAP)。在分子水平上对它们的结构、动力学性质和组装机制进行了探索。
方案设计
为了解分子在水溶液中如何相互作用,经与魔德科技(www.modekeji.cn)技术团队沟通,拟采用分子动力学模拟方法研究了药物SF与分子8和9在水环境下自组装形成纳米粒的过程。8和9具有相同的疏水片段,不同的亲水性片段。并采用量化方法计算不同药物与水溶性分子之间的结合能。
主要结果
MD模拟结果分析
分别提取SF-8和SF-9两个体系MD模拟的最终构象,如图1所示。从图中可以看出,SF-8体系自组装形成的复合物与SF-9有比较明显的差异,前者形成的自组装体更加紧密,而后者并未完全形成自组装结构。
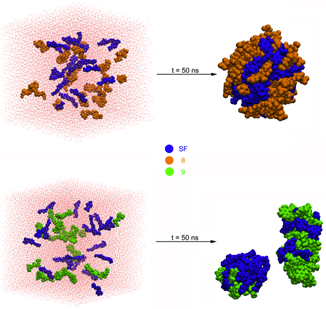
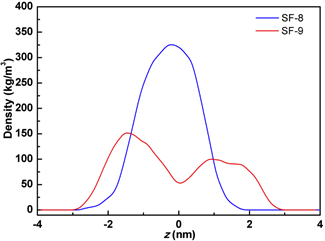
密度分布
为了进一步分析两个体系在模拟过程中的紧密程度,分别对两个体系沿盒子的密度分布进行了分析。如图2所示,从图中可以看出,SF-8体系在盒子中心的密度超过了300 kg/m3,而远离盒子中心的密度明显降低;SF-9体系在盒子中的最大密度仅为150 kg/m3。总体来讲,通过对MD模拟过程中盒子内的体系密度分布分析可以发现,SF-8体系在盒子中心的密度比SF-9明显更高,后者在自组装过程中更加分散。
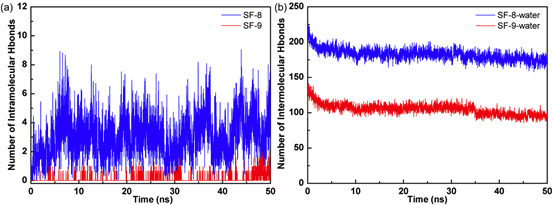
氢键分析
由于SF分子结构中含有较多的氢键供体和受体,因此氢键作用可能是药物与包裹分子自组装成纳米粒子的重要因素之一。为了进一步研究两个体系自组装成纳米粒子过程中的驱动力,本文对MD模拟过程中的纳米粒子内部的氢键以及与水分子的氢键数量分别进行了统计分析。如图3所示,从图3a中可以看出SF与8的氢键数明显比9更多,表明SF与9之间的结合能力相对较弱。另外,图3b给出了SF-8和SF-9纳米粒与溶剂水分子之间的氢键数量,从图中可以看出,SF-8与周围溶剂之间的氢键作用明显更强,而SF-9与水分子的氢键约为SF-8的50%,因此SF-9与水分子的作用较弱,进而导致其无法形成稳定的纳米粒,而形成了沉淀。
溶剂可及表面积
随着纳米粒子在自组装的进行,暴露在溶剂环境中的面积会逐渐减小,因此溶剂可及表面积(SASA)可以用来评价纳米粒子的紧密程度。图4给出了两个体系在模拟过程中的溶剂可及表面积的相对变化,从图中可以看出,两个体系在模拟过程中的SASA值均出现了明显的降低,表明两个体系的分子均出现了不同程度的聚集。具体来讲,SF-8体系的SASA值约降低了70%,而SF-9体系降低了约60%,表明前者形成的纳米粒子更加紧密。
复合物结构优化及能量计算
表1给出了11个体系中药物分子、亲水性分子以及复合物的能量,从表中可以看出,药物-亲水性分子A/G之间的结合能比药物-药物间的结合能更低,即HCPT/G > HCPT/HCPT(-43.63 vs -21.35),SF/G > SF/SF(-54.02 vs -17.19),DTX/G > DTX/DTX(-33.71 vs -5.51),HCPT/A > HCPT/HCPT(-21.76 vs -21.35),SF/A > SF/SF(-36.01 vs -17.19),DTX/A > DTX/DTX(-25.33 vs -5.51),IBR/A > IBR/IBR (-22.07 vs 2.92),LAP/A > LAP/LAP(-28.48 vs -1.06)。表明药物分子更加容易与亲水性分子结合,因此药物分子SF、HCPT、DTX、IBR和LAP在水溶液中能够与亲水性分子A和G形成更强的相互作用,进而阻止其自身的聚集沉淀。
| Com.1 | Com.2 | E1(Hartree) | E2(Hartree) | Ecomplex(Hartree) | ΔE(kcal/mol) |
| HCPT | G | -1257.727779 | -2840.326418 | -4098.123729 | -43.63 |
| SF | G | -2014.728665 | -2840.327096 | -4855.141848 | -54.02 |
| DTX | G | -2931.682065 | -2840.327242 | -5772.063034 | -33.71 |
| DTX | DTX | -2931.686548 | -2931.696425 | -5863.391753 | -5.51 |
| HCPT | A | -1257.727898 | -3838.769439 | -5096.532012 | -21.76 |
| SF | A | -2014.749806 | -3838.767752 | -5853.574951 | -36.01 |
| DTX | A | -2931.675866 | -3838.751032 | -6770.467265 | -25.33 |
| IBR | A | -1446.402924 | -3838.780485 | -5285.218574 | -22.07 |
| IBR | IBR | -1446.391610 | -1446.390626 | -2892.777590 | 2.92 |
| LAP | A | -2599.281813 | -3838.768037 | -6438.095244 | -28.48 |
| LAP | LAP | -2599.282509 | -2599.283451 | -5198.567645 | -1.06 |
两种天然药物甘草酸(G)和七叶皂苷钠(A)几乎都与药物分子形成氢键,结合能在-20 Kcal/mol以下。SF/G、SF/A、HCPT/G、HCPT/A、DTX/A、DTX/G、IBR/A和LAP/A全部共组装成纳米结构。这些结果支持了药物偶联策略,即SMA可以有效地将疏水药物转化为具有高载药量的纳米组装体。
通过分子动力学(MD)模拟和量子化学计算,推测纳米组装体的形成与分子间相互作用以及疏水药物与药伴的结合能有关。此外,得到的SF/VECOONa纳米组装体作为模板,其具有超高的载药量(46%),药代动力学得到了改善,生物利用度得到了提高,治疗效果得到了增强。


